Sichelzellanämie und Beta-Thalassämie: Erste Gentherapie mit CRISPR in Großbritannien zugelassen
Die britische Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) hat die erste Therapie mit der Genschere CRISPR/Cas für zwei Blutkrankheiten zugelassen. Die Therapie mit dem Namen »exa-cel« soll die Symptome von Patientinnen und Patienten mit Sichelzellanämie und Beta-Thalassämie lindern und die Krankheiten womöglich sogar dauerhaft heilen.
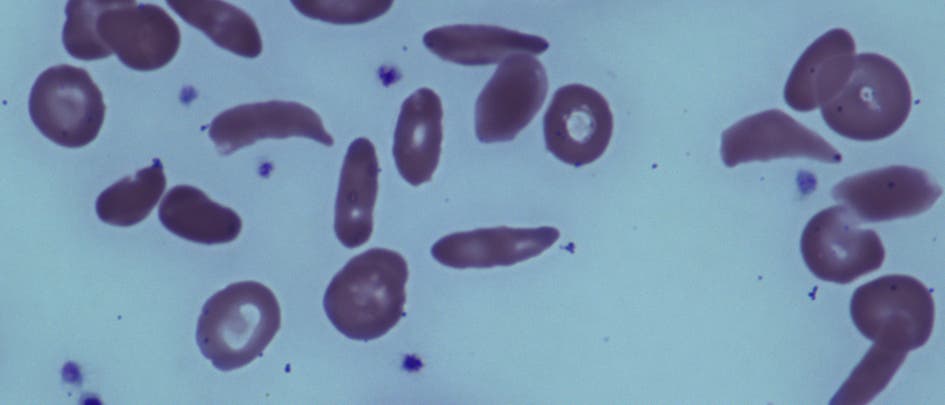
Bei den Betroffenen wird der rote Blutfarbstoff Hämoglobin, an dem letztlich der Sauerstofftransport durch den Körper hängt, nicht richtig gebildet. Menschen mit Beta-Thalassämie bilden durch einen Gendefekt kein oder zu wenig Hämoglobin. Sie entwickeln dadurch meist eine schwere Blutarmut und sind auf regelmäßige Bluttransfusionen angewiesen. Besonders häufig kommt die Krankheit im Mittelmeerraum, im Nahen Osten und in Südostasien vor. Bei Personen mit Sichelzellanämie entsteht statt des normalen Hämoglobins A ein abnormales Hämoglobin S. Reichert es sich in den roten Blutkörperchen an, nehmen diese eine Sichelform ein, die weniger flexibel ist und Blutgefäße verstopfen kann, wodurch Gewebe nicht mehr richtig mit Sauerstoff versorgt wird. Die Folge sind Schmerzen und Organschäden, die im schlimmsten Fall bis zum Nieren- oder Herzversagen reichen. Weltweit werden jährlich rund 400 000 Kinder mit Sichelzellanämie geboren, die überwiegende Mehrheit davon in Afrika.
Die exa-cel-Therapie wirkt, indem sie das fehlende oder abnormale Hämoglobin durch fetales Hämoglobin ersetzt. Das ist eine Form des Proteins, die normalerweise nur vor und kurz nach der Geburt im Körper gebildet wird. Fetales Hämoglobin hat eine höhere Sauerstoffaffinität als Hämoglobin A, was im Mutterleib sicherstellt, dass das ungeborene Kind auch ausreichend über die Plazenta mit Sauerstoff versorgt wird. Nach der Geburt wird seine Produktion nach und nach zurückgefahren und – bei gesunden Menschen – durch die von Hämoglobin A ersetzt.
Bei exa-cel werden Patienten zunächst Blutstammzellen entnommen. In diesen wird dann mit CRISPR das Gen zerstört, das die Produktion des fetalen Hämoglobins hemmt. Anschließend werden die veränderten Zellen in den Körper zurückgeführt. Bei Patienten mit Beta-Thalassämie kompensiert das fetale Hämoglobin, das die Zellen daraufhin wieder produzieren, das fehlende Hämoglobin A. Bei Personen mit Sichelzellanämie verdünnt es das schädliche Hämoglobin S und verhindert so, dass sich die Blutkörperchen verformen.
Die Zulassungsstudien beruhen bislang nur auf Daten von wenigen Patienten, zeigten aber viel versprechende Ergebnisse. An der Studie zur Sichelzellanämie nahmen 45 Patienten teil, von denen 29 lange genug dabeiblieben, um mit ihren Daten in die Auswertung einzufließen. 28 von ihnen waren mindestens ein Jahr nach Behandlung frei von Schmerzkrisen. An der zweiten Untersuchung nahmen 54 Patienten mit Beta-Thalassämie teil, die regelmäßige Bluttransfusionen benötigten. Von den 42 Personen, die in die Auswertung miteinbezogen wurden, konnten 39 in den folgenden zwölf Monaten auf Bluttransfusionen verzichten. Ähnliche Erfolge lassen sich bislang nur mit einer Stammzelltransplantation erreichen.
Eine Behandlung kostet bis zu 2 Millionen Euro
»Der große Vorteil der CRISPR-Therapie ist, dass es anders als bei der Stammzelltransplantation weder eine Immunreaktion des Körpers gibt, die zu einer Abstoßung führt, noch eine Immunreaktion des Spenders, die so genannte Graft-versus-Host-Erkrankung. Denn es sind ja die eigenen Zellen, die zurück in den Körper kommen«, erklärt Selim Corbacioglu, Leiter der Abteilung für Pädiatrische Hämatologie, Onkologie und Stammzelltransplantation am Universitätsklinikum Regensburg, wo im Rahmen der Zulassungsstudien ebenfalls Patienten mit der CRISPR-Therapie behandelt wurden. Dennoch denkt Corbacioglu nicht, dass die Gentherapie die Stammzelltransplantation auf absehbare Zeit ersetzen wird. Sie werde sie eher ergänzen, sagte er gegenüber dem Science Media Center (SMC).
»Die Kosten der CRISPR-Therapie werden die Anwendung beschränken«, sagt Joachim Kunz, Oberarzt der Klinik für pädiatrische Onkologie, Hämatologie und Immunologie sowie ärztlicher Leiter der Spezialsprechstunde für seltene Anämien und Hämoglobinkrankheiten am Universitätsklinikum Heidelberg. Die Behandlung werde vermutlich 1,5 bis 2 Millionen Euro pro Patient kosten und im besten Fall frühestens nach Jahrzehnten von den Einsparungen kompensiert, die Krankenkassen auf der anderen Seite machen, weil Patienten mit Sichelzellanämie dann seltener auf Grund von Komplikationen behandelt werden müssen, erklärte er gegenüber dem SMC. Eine andere Gentherapie gegen Beta-Thalassämie werde in Deutschland bereits nicht mehr angeboten, weil das Unternehmen, das sie entwickelte, in den Verhandlungen mit den Kostenträgern nicht den erwünschten Preis erzielen konnte. Aber auch Stammzellen in ausreichender Menge von Patienten zu gewinnen und anschließend im Labor zu modifizieren, sei ein aufwändiges Unterfangen, wodurch die Therapie nur einer begrenzten Zahl von Patienten zur Verfügung stehen dürfte.
Die Nebenwirkungen der Therapie sind ebenfalls nicht ohne: Um Platz für die neuen, genmanipulierten Stammzellen zu schaffen, müssen die anderen Stammzellen im Körper zunächst mit einer hochdosierten Chemotherapie zerstört werden. Das kann zu Unfruchtbarkeit führen und die Entstehung von Krebserkrankungen begünstigen. Letzteres gilt auch für ungewollte Zellmodifikationen, die theoretisch bei der Anwendung von CRISPR entstehen können: Die Genschere ist zwar ein sehr präzises Tool, aber längst kein völlig fehlerfreies. »Selbst wenn nur einzelne Zellen versehentlich so verändert werden, dass sie einen Wachstumsvorteil gegenüber anderen Stammzellen haben, könnte das im schlimmsten Fall zur Entwicklung einer Leukämie führen«, erläutert Kunz.
Da die ersten Patienten 2019 mit exa-cel behandelt wurden, lässt sich noch nicht sicher sagen, ob durch die Therapie Spätfolgen in dieser Richtung zu befürchten sind. Auch die Frage, ob die Verbesserung der Symptomatik tatsächlich lebenslang anhält, können Forscherinnen und Forscher noch nicht beantworten.
Die US-amerikanische Arzneimittelbehörde FDA will in den kommenden Monaten ebenfalls eine Entscheidung über die Zulassung von exa-cel treffen. Bei der europäischen EMA läuft derzeit noch ein Bewertungsverfahren.
Schreiben Sie uns!