Lexikon der Chemie: Eliminierung
Eliminierung, Reaktionstyp der organischen Chemie, der durch Abspaltung von zwei Gruppen (Atome, Moleküle, Ionen) aus einer Kohlenstoffverbindung charakterisiert ist. Man unterscheidet α-E. und β-E., wobei bei ersterer beide Gruppen von einem C-Atom unter Bildung von Carbenen abgelöst, bei der β-E. die beiden Gruppen von zwei benachbarten C-Atomen unter Bildung von Alkenen abgespalten werden:
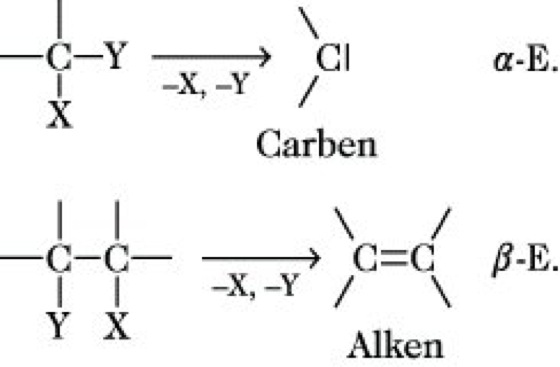
Seltener ist eine γ-E., bei der Cyclopropanderivate entstehen. Die α-E. wird durch starke Basen bewirkt, die häufigere β-E. kann nach verschiedenen Mechanismen ablaufen:
Reaktionen sind in der Gasphase unter Pyrolysebedingungen bei 100-500 °C möglich; sie laufen über einen cyclischen Übergangszustand, wobei sich Bindungsbruch und -bildung synchron vollziehen. Bekannte Beispiele dafür sind die Esterpyrolyse, die Tschugaeff-Reaktion oder die Cope-Eliminierung.
Bei Reaktionen in Lösung unterscheidet man den E1-Mechanismus (monomolekular) und den E2-Mechanismus (bimolekular). Die E1-Reaktion erfolgt zweistufig und steht mit der SN1-Reaktion (Substitution) in Konkurrenz, mit der sie den geschwindigkeitsbestimmenden langsamen ersten Reaktionsschritt, die Bildung eines Carbenium-Ions, gemeinsam hat. Der zweite Schritt erfolgt sehr schnell und unterscheidet sich von der SN1-Reaktion, bei der ein Reagens Y- an das Carbenium-Ion addiert wird.
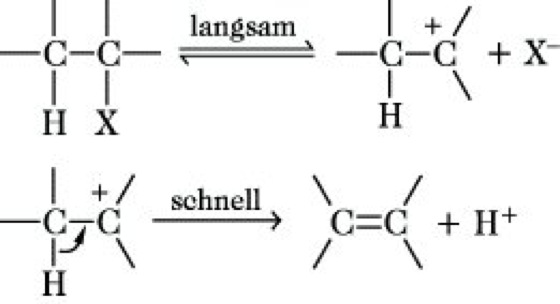
Insgesamt erfolgt die Abspaltung von HX (z. B. für X = Br: Eliminierung von HBr). Besondere sterische und elektronische Bedingungen, die die Bildung und Stabilisierung der ebenen Carbenium-Ionen bewirken, begünstigen und ermöglichen den E1-Mechanismus, der z. B. charakteristisch für die säurekatalysierte Dehydratisierung sekundärer und tertiärer Alkohole ist:
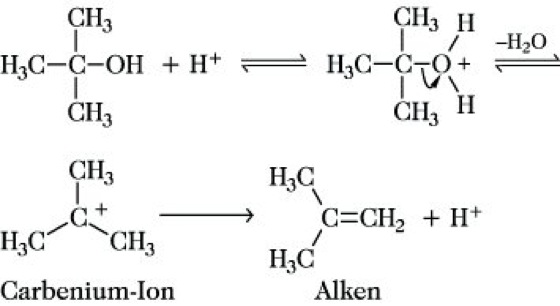
Insgesamt erfolgt die Abspaltung von Wasser aus tert-Butanol unter Bildung von Isobuten.
Die E. nach dem E2-Mechanismus ist die in Lösung verbreitetere Reaktion, wobei eine Base die gleichzeitige Abspaltung der Gruppen X und Y bewirkt (Y ist oft gleich H):
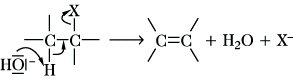
Der dabei durchlaufene Übergangszustand unterscheidet sich von der konkurrierenden SN2-Reaktion (Substitution) eindeutig:

Hohe Konzentrationen starker Basen wie OH-, RO-, H2N- oder Me3N| und besonders auch voluminöser Basen wie z. B. Ethyldicyclohexylamin begünstigen den E2-Mechanismus, d. h. den Angriff der Base am β-C-Atom gegenüber der SN2-Reaktion mit dem Angriff der Base (bevorzugt solche mit hoher nucleophiler Kraft) am α-C-Atom. Nach einem E2-Mechanismus laufen z. B. die Dehalogenierung, die Dehydrohalogenierung oder die Hofmann-Eliminierung ab. Unabhängig von diesen mechanistischen Betrachtungen existiert bei der β-E. die Fragestellung, in welche Richtung bei einer längeren bzw. verzweigten C-Kette die Eliminierung erfolgt, wenn mehrere Möglichkeiten der Produktbildung gegeben sind. Nach Hofmann (Hofmannsche Regel, Hofmann-Orientierung) entstehen Alkene mit der geringsten Anzahl von Alkylgruppen an der C=C-Doppelbindung, eindeutig aus primären Alkylverbindungen
![]()
, jedoch bei bestimmten sterischen Hinderungen im Übergangszustand auch aus sekundären oder tertiären Verbindungen. Nach Saytzeff (Saytzeff-Regel, Saytzeff-Orientierung) wird bevorzugt das Alken gebildet, das den höchsten Alkylierungsgrad an der Doppelbindung aufweist:
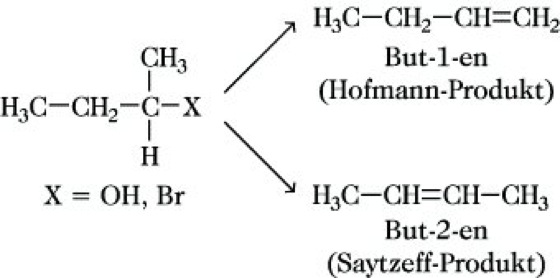
Das Saytzeff-Produkt entsteht bevorzugt bei Verbindungen mit Gruppen großer Abspaltungstendenz, das Hofmann-Produkt ist um so mehr bevorzugt, je schwerer die Protonenabspaltung aus der Mitte des Moleküls, durch sterische Effekte der Base bedingt, erfolgt. E1-Reaktionen ergeben überwiegend Saytzeff-Produkte.
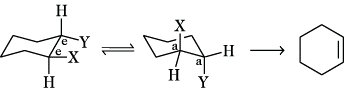
E2-Reaktionen sind in der Regel stereospezifische trans-Eliminierungen, als anti-Eliminierung bezeichnet. Die Anordnung der Gruppen X und Y ist dabei anti-periplanar (gestaffelte Konformation, Stereoisomerie) und bewirkt eine besonders glatte E. Weniger begünstigt ist die syn-Eliminierung aus einer syn-periplanaren Konformation. Bei Cycloalkanderivaten erfolgt die E. aus einer bis-axialen Anordnung (Stereoisomerie) der Gruppen X und Y heraus (a,a). Da die bis-äquatoriale Anordnung e,e von 1,2-disubstituierten Cycloalkanen in die bis-axiale Konformation umklappen kann, sind beide gleichberechtigt. E. aus den cis-Verbindungen mit a,e- oder e,a-Anordnung von zwei Substituenten sind im allgemeinen nicht möglich.
Schreiben Sie uns!