Lexikon der Biochemie: Diskelektrophorese
Diskelektrophorese, diskontinuierliche Elektrophorese, eine Variante der Gelelektrophorese (Elektrophorese), die das Aggregieren von Proteinen beim Eintritt in das Gel verhindert, wodurch schärfere Banden (engl. disc für scharfe, scheibenförmige Banden, stellt auch einen Bezug zur Bezeichnung der Methode her) resultieren. Bei der D. verwendet man ein engporiges Trenngel und ein weitporiges Sammelgel und kombiniert darüber hinaus mit verschiedenen Puffern. Sehr häufig eingesetzt wird das Tris-Chlorid/Tris-Glycin-System (Abb.), wobei das Trenngel 0,375mol·l-1 Tris-HCl, pH 8,8, und das Sammelgel 0,125mol·l-1 Tris-HCl, pH 6,8 enthält. Am Anfang der Trennung hat Glycin (pH nahe am isoelektrischen Punkt) eine geringe elektrophoretische Mobilität und fungiert daher als Folge-Ion, während Chlorid-Ionen sich sehr schnell bewegen (Leit-Ionen). Beim Auftragen der Proteinmischung liegen die Mobilitäten der Protein-Ionen zwischen Leit- und Folge-Ionen. Im elektrischen Feld wandern alle Ionen mit der gleichen Geschwindigkeit (Isotachophorese). Im Leit-Ionenbereich stellt sich eine niedrige Feldstärke ein, während im Folge-Ionenbereich die Feldstärke automatisch sehr hoch ansteigt. Dadurch befinden sich die Protein-Ionen in einem Feldstärkegradienten. In der Reihenfolge ihrer Mobilitäten bildet sich ein Protein-Stapel aus. Aufgrund dieses Stapeleffekts wandern die Proteine langsam ohne Aggregation in die Gelmatrix und es erfolgt somit eine Vortrennung und Konzentrierung der Zonen am Start. Beim Erreichen der Grenzschicht des engporigen Trenngels werden die Proteine sehr plötzlich einem hohen Reibungswiderstand ausgesetzt. Dadurch kommt es zu einer zusätzlichen Zonenschärfung. Da das niedermolekulare Glycin davon nicht beeinflusst wird, werden die Proteine überholt, die sich nunmehr in einem homogenen Puffer befinden, und der Proteinstapel löst sich nach den Prinzipien der Zonenelektrophorese auf. Aufgrund des auf pH 9,5 ansteigenden pH-Werts erhalten die Proteine höhere Nettoladungen. Im engporigen Trenngel wirkt sich die Molekülgröße signifikant auf die Mobilität aus. Für basische Proteine mit einem isoelektrischen Punkt über 6,8 muss ein anderes Puffersystem verwendet werden.
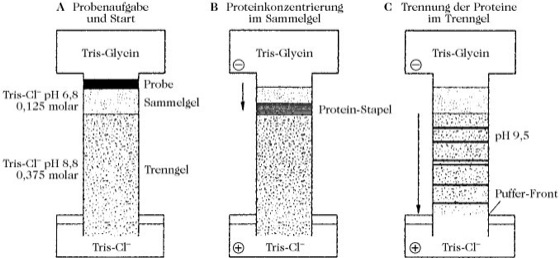
Diskelektrophorese.A: Die Probe wird auf ein großporiges Sammelgel aufgetragen. Der Laufpuffer enthält kleine Chloridionen mit sehr hoher Mobilität und größere Glycin-Ionen mit geringerer Mobilität. Zwischen diesen Ionen sammeln sich die Protein-Ionen. B: Beim Eintritt in das kleinporigere Trenngel, werden die Protein-Ionen stark abgebremst, sodass sie von den Glycin-Ionen überholt werden. Dies hat einen starken Konzentrierungseffekt zufolge. C: Im Trenngel werden die konzentrierten Proteinbanden bei pH 9,5 nach ihrer Größe aufgetrennt. [nach: F. Lottspeich u. H. Zorbas (Hrsg.) Bioanalytik, Spektrum Akademischer Verlag, 232]
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.