Lexikon der Biochemie: Puffer
Puffer, ein System, das pH-Änderungen gegenüber beständig ist und sie bei Zugabe bzw. Verlust von Säure und Base minimal hält. Unter physiologischen Bedingungen stabilisieren P. den pH-Wert von Zellen und Körperflüssigkeiten bei metabolischer Unter- bzw. Überproduktion von Säuren und Basen oder bei Änderungen der Wasserstoffionenkonzentration. Im Labor werden P. verwendet, um konstante und günstige pH-Werte für enzymatische Reaktionen zu erhalten, um das Protein vor Denaturierung zu schützen und um passende pH-Bedingungen für die Kultur von Mikroorganismen und Geweben zur Verfügung zu stellen. Gepufferte Lösungen werden auch als Elutionsmittel in der Chromatographie, als Elektrophoresemedium u.a. eingesetzt.
Die Pufferwirkung wird beschrieben durch die Henderson-Hasselbach-Gleichung: pH = pK + log ([Salz]/[Säure]), bzw. pH = pK + log ([konjugierte Base]/[Säure]).
Wenn der Quotient [konjugierte Base]/[Säure] gleich eins ist, d.h. die Hälfte der Säure-Ionen titriert ist, ist pH = pK. In der aus der Gleichung resultierenden Titrationskurve ergibt sich ein Plateau, auf dem der pH-Wert von der Zugabe von Säure oder Base relativ unbeeinflusst bleibt. Dieses Plateau entspricht dem Puffergebiet und ist durch den pK-Wert definiert (Abb. 1, s. auch Titrationskurven der Aminosäuren). Als Regel gilt, dass das Puffergebiet dem pK'-Wert ±1 pH-Einheit entspricht. Das Phosphatsystem (NaH2PO4) ist der beliebteste und am meisten verwendete biochemische P. Es hat jedoch die Nachteile, dass es oberhalb pH 7,5 geringe Pufferkapazität besitzt, dazu tendiert, polyvalente Kationen auszufällen, und Phosphat in einigen Systemen ein Metabolit ist.
Ein idealer P., der im pH-Bereich der meisten biologischen Reaktionen wirksam sein sollte, müsste einen pK-Wert zwischen 6 und 8 besitzen, in Wasser sehr gut löslich sein und keine biologischen Membranen passieren.
Alle P. werden von der Temperatur beeinflusst, so dass sich der bei Raumtemperatur gemessene pH-Wert signifikant von jenem bei der Arbeitstemperatur unterscheiden kann.
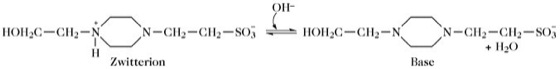
Pufferkapazität. Während der pH-Wert von pK' und dem Quotienten [Protonenakzeptor]/[Protonendonor] abhängt, wird die Pufferkapazität durch die Menge der vorhandenen Pufferkomponenten bestimmt. Die Pufferkapazität ist definiert als die minimale Menge an Säure oder Base, die hinzugefügt bzw. entfernt werden muss, um eine signifikante pH-Änderung hervorzurufen. Zum Beispiel können zwei Lösungen von 4-(2-Hydroxyethyl)-piperazin-1-ethanolsulfonsäure (HEPES) bei pH 7,05 und bei gleichem Volumen verschiedene Mengen an Zwitterion und Base enthalten (Abb. 2).
pH (7,05) = pK (7,55) + log [Base]/[Zwitterion].
Lösung 1 (0,05M):
[Base]/[Zwitterion] = 0,038/0,012
Lösung 2 (0,10 M):
[Base]/[Zwitterion] = 0,076/0,024
Lösung 2 hat bei gleichem pH-Wert eine doppelt so hohe Pufferkapazität wie Lösung 1, d.h. Lösung 2 kann doppelt so viele Protonen wie Lösung 1 aufnehmen, bis eine signifikante pH-Wertänderung eintritt. In der medizinischen Physiologie entspricht die Pufferkapazität dem Betrag an Säure oder Base, der von Körperflüssigkeiten aufgenommen werden kann, bevor der pH-Wert gefährlich hoch oder niedrig wird.
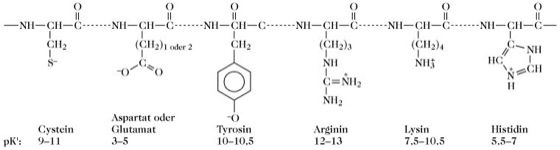
P. in Körperflüssigkeiten. Säuren und Basen, die durch den Stoffwechsel produziert werden, gelangen in die Körperflüssigkeiten und werden am Ende ausgeschieden. Die Körperflüssigkeiten werden temporär durch ihre Puffersysteme geschützt (im Allgemeinen mehr gegen Säure, weil der normale Stoffwechsel zu einer Nettoproduktion von Säure führt). Dabei können auch Proteine als P. wirken, da viele der sauren und basischen Aminosäureseitenketten auf der Oberfläche von Proteinen pK'-Werte aufweisen, die es ihnen ermöglichen, einen Beitrag zum physiologischen Puffersystem zu leisten (Abb. 3).
Das Hauptpuffersystem im Blut ist das Bicarbonat (HCO ![]()
/CO2) mit einer Konzentration von [HCO ![]()
] = 0,02-0,03M (20-30 Moläquivalente/l). Hämoglobin (Desoxyhämoglobin/Desoxyhämoglobin·H+, Oxyhämoglobin/Oxyhämoglobin·H+) stellt weitere 10 Moläquivalente/l an Pufferkapazität zur Verfügung und Phosphat leistet einen kleinen Beitrag von 1,5Moläquivalenten/l. Die fünf Liter Blut eines durchschnittlichen Erwachsenen sind in der Lage, 0,15mol H+ aufzunehmen, bevor der pH-Wert gefährlich niedrig wird. Die bedeutenden P. des Körpers sind jedoch in anderen Geweben vorhanden. Die gesamte Muskulatur des Körpers z.B. kann fünfmal mehr Säure neutralisieren als das Blut und das HCO ![]()
/CO2-System stellt nur ein Zehntel der gesamten Pufferkapazität des Körpers dar. Da alle Puffersysteme des Körpers miteinander in Wechselwirkung treten können, spiegeln sich alle Änderungen im Säure/Base-Gleichgewicht des Körpers im Blut wider. Diese gegenseitige Pufferung durch Verschieben des H+ von einem Körpersystem in ein anderes wird auch isohydrisches Prinzip genannt.
Bicarbonat wirkt nicht nur als Blutpuffersystem, sondern stellt auch die Hauptform dar, in der CO2 von den atmenden Geweben zur Lunge transportiert wird, wo es ausgeatmet wird. Ein kleiner Teil des CO2 wird als Carbaminogruppe von Proteinen transportiert: Protein-NH2 + CO2![]()
Protein-NH-COOH ![]()
Protein-NH-COO- + H+, und ungefähr 80 % des CO2 wird als Bicarbonat transportiert. Dabei stehen die verschiedenen Transportformen des CO2 im Blut miteinander im Gleichgewicht (Abb. 4).
Um das gelöste CO2 in hohe HCO ![]()
-Konzentrationen zu überführen, muss das entstehende H+ entfernt werden, d.h. durch ein Puffersystem aufgefangen werden. Die Hauptpuffer, die diese Funktion ausüben, sind die Plasmaproteine (verantwortlich für ca. 10 % der Protonen), das Erythrocytenphosphat (ca. 20 %) und das Erythrocytenhämoglobin (60-70 %). Zur Rolle des Hämoglobins: Bohreffekt, Hämoglobin.
[G. Gomori Methods in Enzymology1 (1955) 138-146; N.E. Good et al. Biochemistry5 (1966) 467-477; N.E. Good u. S. Izawa Methods in Enzymology24B (1972) 53-68; W.J. Fergusun et al. Anal. Biochem.104 (1980) 300-310]
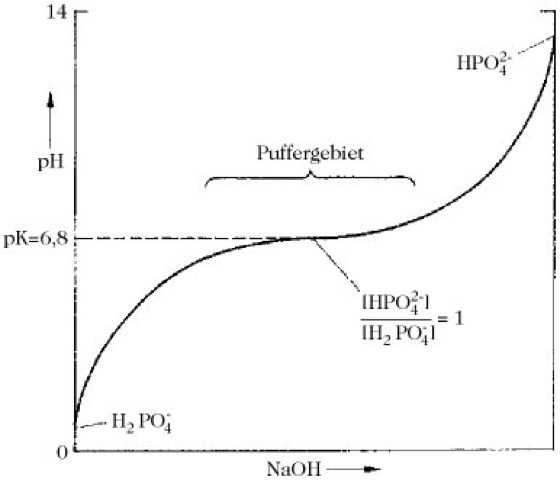
Puffer. Abb. 1. Titrationskurve von H2PO ![]()
.

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.