Lexikon der Biochemie: Isoflavonoid
Isoflavonoid, ein Flavonoid mit dem verzweigten C6C3C6-Grundgerüst (Abb. 1).
Die meisten I. enthalten das 3-Phenylchromangerüst, in dem die C3-Kette mit Sauerstoff zyklisiert vorliegt.
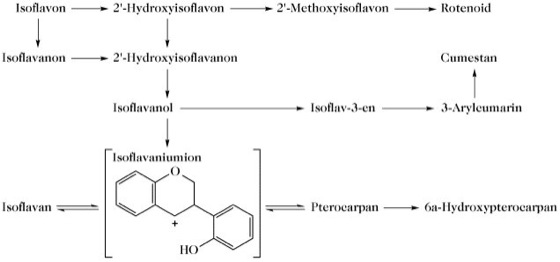
Zu den I. zählen Isoflavone, Isoflavanone, Isoflavane, Isoflav-3-ene, Rotenoide, Pterocarpane, Cumestane, 3-Aryl-4-hydroxycumarine, 2'-Hydroxy-3-arylcumarine, 2-Arylbenzofurane, α-Methyldesoxybenzoine und einzelne Verbindungen wie Lisetin und Ambanol (s. Einzeleinträge). I. haben eine begrenzte botanische Verbreitung und kommen hauptsächlich in den Unterfamilien Papilionoideae der Leguminosen und manchmal in der Unterfamilie Caesalpinioideae vor. Vereinzelt werden sie auch in anderen Familien gefunden (Rosaceae, Moraceae, Amaranthaceae, Podocarpaceae, Chenopodiaceae, Cupressaceae, Iridaceae, Myristicaceae, Stemonaceae). I. kommen auch in mikrobiellen Kulturen vor [z. B. T. Hazato et al. J. Antibiot. Tokyo 32 (1979) 217-222]. Da das Kulturmedium jedoch in allen Fällen Sojamehl enthielt, besteht die Möglichkeit, dass diese I. doch pflanzlichen Ursprungs sind.
Biosynthese. Die Biosynthese aller Flavonoide verläuft über Chalkone. Die 1,2-Arylwanderung, die zum charakteristischen Isoflavonoidgerüst führt, spielt sich während der Umwandlung der Chalkone ab und wird von einer Nettooxidation begleitet. Im Gegensatz dazu, ist an der Biosynthese aller anderen Flavonoide eine Umwandlung des Chalkons in ein Flavanon mit der gleichen Molekülstrukturformel beteiligt. Einer interessanten Theorie für den Mechanismus der Arylwanderung zufolge, verläuft die Phenoloxidation über eine Spirodienonzwischenstufe (Abb. 2) [A. Pelter et al. Phytochemistry10 (1971) 835-850]. In Übereinstimmung mit diesem vorgeschlagenen Mechanismus steht die Erkenntnis, dass 4-Methoxychalkone nicht als Substrate für die Wanderung fungieren. Tatsächlich wären nur zwei Chalkone als Substrate geeignet, das 2',4',4-Trihydroxychalkon und das 2',4',6',4-Tetrahydroxychalkon, aus denen Daidzein und Genistein entstehen könnten. Formononetin und Biochanin A können durch Methylierung von Daidzein und Genistein entstehen, es existieren jedoch zwingende Hinweise dafür, dass die 4'-Methylierung hauptsächlich während der Umwandlung der Chalkone vor sich geht, d. h. während der Arylwanderung. Diese vier I. könnten dann als Vorstufe praktisch aller bekannten natürlichen I. dienen. I., denen die Sauerstofffunktion in 4'-Position fehlt, sind selten. Diese können durch eine analoge Phenoloxidation von 2-Hydroxychalkonen, die zu 2'-Hydroxy- (oder -Methoxy-) Flavonen führt, gebildet werden. Das Substitionsmuster des B-Rings der Isoflavone scheint durch die Hydroxylierungsreihenfolge 4'→2',4'und 4'→4',5'→2',4',5' bestimmt zu sein. Die Substition im A-Ring in den Positionen 7 und 5,7 ist durch die Chalkone vorgegeben, bei Isoflavonen ist jedoch eine weitere Hydroxylierung in Position 6 möglich. Die biosynthetischen Beziehungen innerhalb der Hauptgruppe der I. wurden hauptsächlich mit Hilfe von Isotopenmarkierungen (14C und 3H) untersucht und sind in Abb. 3 gezeigt [P.M. Dewick in The Flavonoids: Advances in Research J.B. Harborne u. T.J. Mabry, Hrg., Chapman and Hall, 1982, 535-640; J.L. Ingham "Naturally Occuring Isoflavonoids (1855-1981)" in Progress in the Chemistry of Organic Natural Products43 (1983) 1-266].
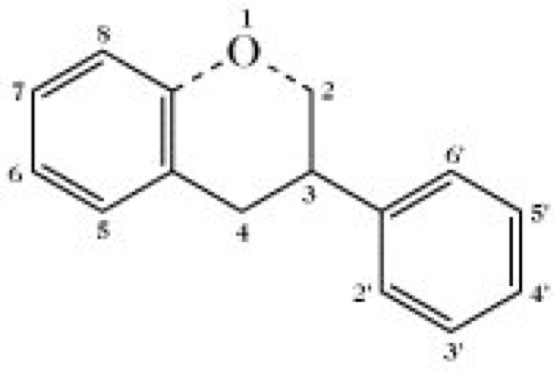
Abb. 1. Isoflavonoid. Das Isoflavonoidringsystem.
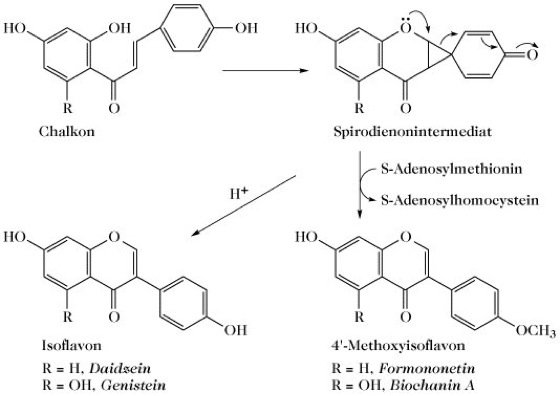
Abb. 2. Isoflavonoid. Vorgeschlagener Mechanismus für die Zyklisierung und
Oxidation von Chalkonen zu Isoflavonen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.