Lexikon der Chemie: Peptidsynthese
Peptidsynthese, ein chem. Mehrstufenprozeß zur gezielten Verknüpfung von Aminosäurebausteinen zu Peptiden. Die P. dient 1) zur Bestätigung der durch Sequenzanalyse ermittelten Primärstruktur von Peptiden und Proteinen und ist vielfach die sicherste Methode für den endgültigen Strukturbeweis, 2) zur Ermittlung der für die biologische Wirkung verantwortlichen strukturellen Parameter von Peptidwirkstoffen im Rahmen von Struktur-Aktivitätsstudien am Beispiel synthetischer Analoga nativer Peptide, 3) zur chem. Veränderung von Peptidwirkstoffen zwecks Modifikation des pharmakologischen Effektes, 4) zur industriellen Bereitstellung von biologisch aktiven Peptiden und deren Analoga, 5) zur Darstellung von Modellpeptiden zum Studium physikochem. Gesetzmäßigkeiten, zur Untersuchung antigener Eigenschaften sowie für Substratstudien in der Enzymologie.
Die P. unter milden Reaktionsbedingungen gelingt nur durch Aktivierung der Carboxyfunktion eines Reaktionspartners und liefert nur dann eindeutig definierte Produkte, wenn alle funktionellen Gruppen, die nicht am Peptidknüpfungsschritt beteiligt sind, temporär durch geeignete Schutzgruppen blockiert werden. Die P., d. h. die Knüpfung einer jeden Peptidbindung, ist ein Mehrstufenprozeß (Abb. 1). Auf der ersten Stufe erfolgt eine selektive Blockierung der funktionellen Gruppen der Aminosäuren, wodurch diese gleichzeitig aus der reaktionsträgen Zwitterionenstruktur entbunden werden. Die mit der Carboxyfunktion in Reaktion tretende Aminosäure, die Carboxykomponente, wird an der α-Aminofunktion reversibel blockiert, während die mit der Aminofunktion angreifende zweite Aminosäure, die Aminokomponente, an der Carboxygruppe geschützt wird. Auf der zweiten Stufe erfolgt die Knüpfung der Peptidbindung durch Aktivierung der Carboxykomponente entweder im Ein topfverfahren oder in einem der Aktivierung folgenden separaten Schritt. Die nächste Stufe beinhaltet die selektive Abspaltung der Schutzgruppen, wenn nicht eine Dipeptidsynthese eine vollständige Deblockierung erfordert.
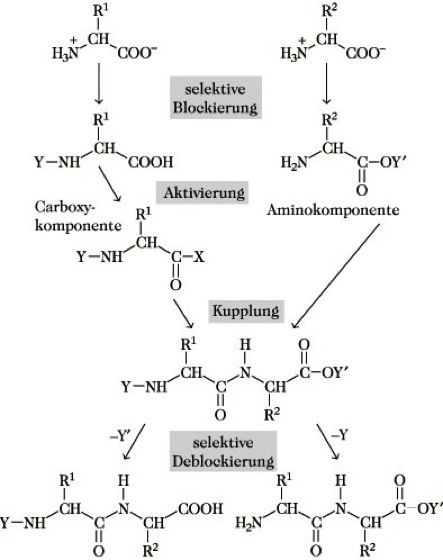
Peptidsynthese. Abb. 1: Knüpfung einer Peptidbindung.
Die partiell blockierten Dipeptidderivate werden dann für die weiteren Synthesestufen als Carboxy- oder Aminokomponente eingesetzt. Neben dem essentiellen Schutz der Aminofunktion der Carboxykomponente und der Carboxyfunktion der Aminokomponente wird die P. dadurch kompliziert, daß von den 21 proteinogenen Aminosäuren neun weitere (Ser, Thr, Asp, Glu, Lys, Arg, His, Tyr und Cys) Drittfunktionen besitzen, die entsprechend den Erfordernissen selektiv geschützt werden müssen. Die unterschiedlichen Selektivitätsanforderungen führen zu einer formalen Unterscheidung zwischen intermediären und konstanten Schutzgruppen. Intermediäre Schutzgruppen dienen der Blockierung terminaler Amino- und Carboxygruppen und müssen aus diesem Grunde selektiv neben den konstanten Schutzgruppen abspaltbar sein, während die konstanten Schutzgruppen erst am Ende der Synthese eines Peptids bzw. manchmal auch auf der Stufe eines Zwischenproduktes entfernt werden. In der Tab. sind einige Schutzgruppen zusammengestellt.
Peptidsynthese. Tab.: Einige ausgewählte Schutzgruppen.
| |||
| Aminoschutzgruppen | |||
| Benzyloxycarbonyl- tert-Butyloxycarbonyl- Fluorenyl-9- methoxycarbonyl- 2-[Biphenylyl-(4)]- propyl-2-oxycarbonyl- | Z- Boc- Fmoc- Bpoc- | HBr/AcOH; H2/Pd; Na/fl. NH3 HCl/AcOH; CF3COOH Morpholin, 2-Aminoethanol 80%iges AcOH | |
| Carboxyschutzgruppen | |||
| Methylester Ethylester Benzylester tert-Butylester | -OMe -OEt -OBzl -OBut | alk. Hydrolyse alk. Hydrolyse NaOH, H2/Pd CF3COOH; HCl/AcOH | |
| Drittfunktionsschutzgruppen | |||
| S-Acetamidomethyl- O-tert-Butyl- NIm-Dinitrophenyl- NG-Tosyl- O-Benzyl- | Acm- But- Dnp- Tos- Bzl- | Hg2+ (pH 4) CF3COOH 2-Mercaptoethanol (pH 8) HF H2/Pd; HF |
Die Aktivierung der Carboxykomponente erreicht man durch Einführen von elektroaffinen -I- bzw. -M-Substituenten (X), die sowohl am Carbonyl-C-Atom als auch am Carbonyl-O-Atom die Elektronendichte verringern, so daß der nucleophile Angriff der Aminokomponente begünstigt wird. Die Kupplungsreaktion sollte unter idealen Bedingungen in hoher Geschwindigkeit ohne Racemisierung und Nebenreaktionen und in hoher Ausbeute bei Einsatz äquimolarer Mengen an Carboxy- und Aminokomponente ablaufen.
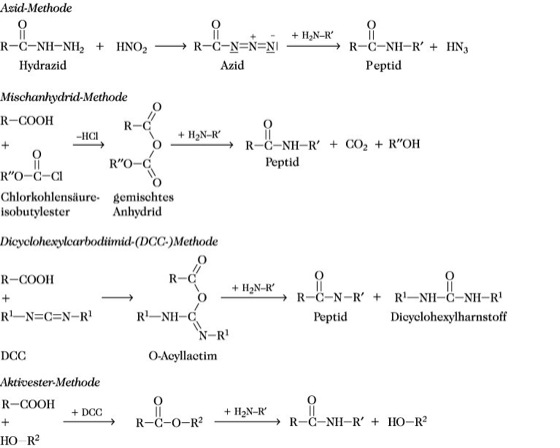
Peptidsynthese. Abb. 2: Ausgewählte Methoden. R Rest der Carboxykomponente, R' Rest der Aminokomponente, R1 Cyclohexyl, R2 Rest der aktivierten Alkyl- bzw. Arylgruppe, R′′ Isobutylrest.
Die Anzahl der mehr als 140 beschriebenen Kupplungsmethoden zeigt, daß es gegenwärtig keine ideale Kupplungsmethode gibt. Trotzdem haben nur wenige Methoden praktische Bedeutung erlangt, wie die Azid-Methode, die Mischanhydrid-Methode, die Aktivester-Methode, die Dicyclohexylcarbodiimid-Methode (Abb. 2) sowie das Dicyclohexylcarbodiimid/Additiv-Verfahren. Von großer Bedeutung sind neuerdings Kupplungsreagenzien, die eine in-situ-Bildung von Aktivestern ermöglichen, wie Benzotriazol-1-yl-oxy-tris(dimethylamino)-phosphonium-hexafluorophosphat (BOP), 2-(1H)-benzotriazol-1-yl-1,1,3,3-tetramethyluronium-hexafluorophosphat (HBTU) oder das 7-Azabenzotriazol-1-yl-oxytris(pyrrolidino)-phosphonium-hexafluorophosphat (PyAOP) neben anderen Uronium- und Phosphoniumsalzen. Während die Darstellung von Di- und Tripeptiden hinsichtlich der Wahl der Schutzgruppen und der Kupplungsmethoden keine großen Schwierigkeiten bereitet, ist für den Aufbau von langen Peptidketten mit definierter Aminosäuresequenz eine exakte Planung unerläßlich. So versteht man unter der Strategie der P. die Reihenfolge der Verknüpfung der Aminosäurebausteine zum Peptid, wobei man zwischen der schrittweisen Kettenverlängerung und der Segmentkondensation unterscheidet. Solche P. können sowohl in homogener Lösung (konventionelle P.) als auch an einer zweiten Phase durchgeführt werden, wobei die Festphasen-Peptidsynthese (Merrifield-Synthese) eine breite Anwendung fand. Durch die Taktik der P. wird die optimale Schutzgruppenkombination und die für jede Knüpfung einer Peptidbindung geeignete Kupplungsmethode ausgewählt. Bei konventionellen P. sind hinsichtlich der Auswahl der Schutzgruppenkombination mit der Maximal- und der Minimalschutztaktik zwei extreme Varianten möglich, die beide sowohl Vorteile als auch Nachteile besitzen. Eine maximale Blockierung der Seitenkettenfunktionen garantiert eine optimale Absicherung gegenüber Nebenreaktionen sowie eine größere Variabilität der Schutzgruppen und Kupplungsmethoden. Die damit verbundenen Löslichkeitsprobleme stellen einen limitierenden Faktor dieser Taktik dar. Generell werden in der Praxis nicht die beiden extremen Taktiken benutzt, sondern man bevorzugt in Abhängigkeit von der aufzubauenden Sequenz eine Annäherung an die eine oder andere Variante.
Obgleich mittels der P. einige kleine Proteine aufgebaut werden konnten, liegt die Grenze für ökonomisch vertretbare Synthesen bei Polypeptiden unter 100 Aminosäurebausteinen. Für bestimmte Zielstellungen stellt die Semisynthese eine Alternative dar. Bei der Semisynthese werden Fragmente nativer Proteine als Zwischenprodukte für den Aufbau neuer Proteine mit veränderter Sequenz verwendet. Die auf diesem Wege zugänglichen modifizierten Proteine besitzen große Bedeutung für molekularbiologische, biochem. und pharmakologische Untersuchungen. Für bestimmte Kupplungsreaktionen werden auch proteolytische Enzyme eingesetzt. Die enzymatische P., die die Reversibilität proteasekatalysierter Reaktionen nutzt, rückte Ende der siebziger Jahre auch in den Blickpunkt des Interesses für die Synthese von Peptidwirkstoffen. Protease-katalysierte Kupplungen besitzen gegenüber chemosynthetischen Verfahren verschiedene Vorteile, wie Wegfall der Racemisierungsgefahr, einfache Prozeßführung bei Raumtemperatur, kein Schutz von Drittfunktionen u. a. Von Nachteil ist ohne Zweifel die fehlende Möglichkeit des universellen Einsatzes von Proteasen aufgrund der vorgegebenen Spezifität, wobei die Substratmimetika-unterstützte Strategie eine neue brauchbare Alternative bietet. Enzyme wurden aber auch mit Erfolg für die selektive Abspaltung von Schutzgruppen eingesetzt. Die P. besitzt den Vorteil der Bereitstellung und gezielten Modifizierung von Peptidwirkstoffen für molekularbiologische Studien sowie für die medizinische Nutzung. Die kombinierte Anwendung chemosynthetischer und enzymatischer Methoden wird in der Zukunft ebenso bedeutungsvoll sein wie die Weiterentwicklung semisynthetischer Techniken und die Anwendung der Gentechnologie für die Produktion wichtiger Peptid- und Proteowirkstoffe.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.