Lexikon der Chemie: Farbstofftheorie
Farbstofftheorie, erklärt die Farbigkeit von Substanzen, insbesondere von Farbstoffen. Die Farbigkeit von Substanzen beruht auf ihrer Fähigkeit, aus dem Spektrum des sichtbaren Lichtes einen Teil zu absorbieren. Zwischen der Absorption einer Substanz und der wahrnehmbaren Farbe besteht der folgende Zusammenhang: Das menschliche Auge vermag polychromatisches Licht nicht in seine Bestandteile zu zerlegen. Es wird nur eine Farbe wahrgenommen, die durch Summierung über alle ins Auge gelangenden Lichtstrahlen entsteht. Wenn die spektrale Zusammensetzung des Tageslichtes nicht verändert wird, so ist dieser Eindruck weiß. Erst wenn Teile des Spektrums durch Absorption ausgelöscht werden, entsteht ein farbiger Eindruck, welcher der absorbierten Spektralfarbe komplementär ist. In der oberen Reihe der Abb. 1 sind die Wellenlängenbereiche der einzelnen Spektralfarben, in der unteren ihre Komplementärfarben angegeben. Eine Substanz, die z. B. im blauen Spektralbereich absorbiert, erscheint dem Auge gelb. Treten im sichtbaren Gebiet mehrere Absorptionsbanden auf, so besteht kein einfacher Zusammenhang mehr, und die Farbe der Substanz läßt sich aus dem Absorptionsspektrum nur schwer vorhersagen.
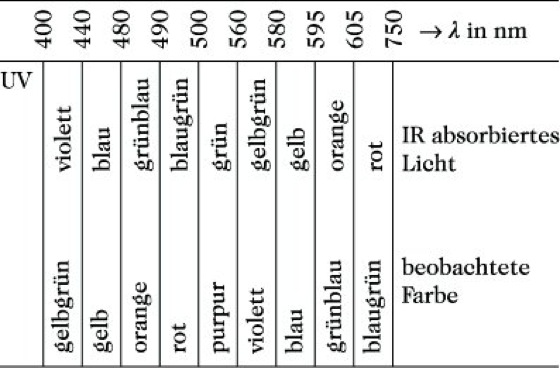
Farbstofftheorie. Abb.1: Zusammenhang zwischen Lichtabsorption und beobachteter Farbe.
Die Farbigkeit organischer Verbindungen läßt sich erklären aus der Existenz dreier idealer Grundzustände, des aromatischen, des polyenischen und des Polymethin-Zustandes (Abb. 2). Durch den kontinuierlichen Übergang zwischen diesen drei Idealzuständen ist die große Vielfalt der Farbstoffe verständlich. Es gelten folgende Regeln: 1) Bei gleicher Molekülgröße oder gleicher π-Elektronenzahl haben die Polymethinstrukturen die langwelligste Lichtabsorption und damit die tiefste Farbe (Abb. 3). 2) Wird bei einer Modifizierung, z. B. einer Verzweigung, die Ladungsdichte aufrechterhalten, dann absorbiert die Verbindung bei kürzeren Wellenlängen als das längste im Molekül enthaltene Polymethinfragment. Verbindungen dieses Typs werden als verzweigte oder alternierende Polymethine bezeichnet. 3) Wird bei einer Modifizierung des Grundfarbenträgers die charakteristische Ladungsverteilung gestört, dann absorbiert die Verbindung bei längeren Wellenlängen als das längste im Molekül enthaltene Polymethinfragment. Derartige Polymethine werden nichtalternierende Polymethine genannt. 4) Wird die Polymethinstruktur in nichtalternierenden Polymethinen durch die Konkurrenz einer aromatischen Struktur aufgehoben, dann absorbieren die Verbindungen bei kürzeren Wellenlängen als das längste im Molekül enthaltene Polymethinfragment. Die Verbindungen verhalten sich dann wie substituierte Aromaten. 5) Wird die Symmetrie der π-Elektronenverteilung entlang der Polymethinkette durch Substituenten vermindert, so tritt Farbaufhellung ein. Außer den Nitrosoalkanen sind nahezu alle organischen Verbindungen, deren Moleküle nur Einfachbindungen bzw. isolierte Mehrfachbindungen enthalten, farblos. Eine einzelne Mehrfachbindung verursacht eine oder mehrere Absorptionsbanden zwischen 150 und 300 nm.
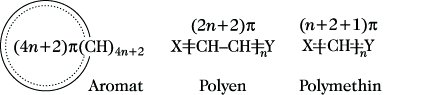
Farbstofftheorie. Abb. 2. Triadenlehre.
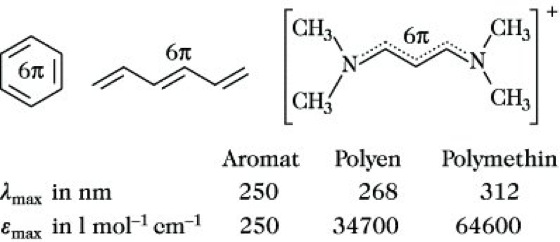
Farbstofftheorie. Abb. 3. Vergleich der Absorptions-Wellenlängen von Aromat, Polyen und Polymethin.
Bereits vor Aufklärung dieser Zusammenhänge war empirisch festgestellt worden, daß als chromophore Gruppen bezeichnete Atomgruppen mit Mehrfachbindungen Farbigkeit bei Molekülen hervorrufen. Andere Gruppen, die auxochromen Gruppen, rufen selbst keine Farbigkeit hervor, verstärken aber Intensität und Farbtiefe farbiger Verbindungen. Bestimmte Substituenten, die die entgegengesetzte Wirkung ausüben, bezeichnet man als antiauxochrome Gruppen. Die üblichen Farbstoffe enthalten in der Regel sowohl chromophore als auch auxochrome Gruppen. Eine Verschiebung der Absorptionsbanden zum langwelligen Spektralbereich erfolgt durch eine Verschiebung nach dem kurzwelligen Spektralbereich hin durch hypsochrome Gruppen (Hypsochromie). In manchen Fällen, z. B. bei den Triphenylmethanfarbstoffen, werden farblose Verbindungen dadurch farbig, daß am zentralen C-Atom durch Salzbildung entweder ein freies Elektronenpaar oder eine Oktettlücke entstehen, die die Einstellung mesomerer Zustände zwischen den verschiedenen aromatischen Kernen erleichtern (Halochromie).
Die auf der F. basierende Strukturaufklärung farbiger Verbindungen erfolgt durch die UV-VIS-Spektroskopie. Farbstoffe können in Lösungsmitteln unterschiedlicher Polarität verschiedene Farben aufweisen (Solvatochromie). Durch die unterschiedliche Polarität des Lösungsmittels sind Übergänge zwischen der Polymethin- und Polyenstruktur sowie die Aromat- und Polymethinstruktur möglich (Abb. 4).
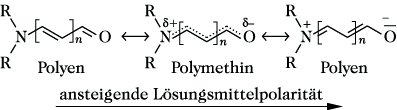
Farbstofftheorie. Abb. 4.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.