Lexikon der Chemie: Isotopentrennung
Isotopentrennung, die mehr oder weniger vollständige Trennung (genauer die Anreicherung von einzelnen Isotopen) der in Form polynuclidischer chem. Elemente (Mischelemente) vorliegenden Isotopengemische nach verschiedenen physikalischen oder chem. Methoden. Besondere Bedeutung hat die I. bei der Gewinnung von Kernbrennstoffen. Die I. beruht auf den Isotopieeffekten (Isotope). Als Anreicherungsfaktor q bezeichnet man den Quotienten der Isotopenhäufigkeitsverhältnisse nach (a'/b') und vor (a/b) der I.: q = (a'/b')/(a/b). Um die sehr kostspielige Trennung der Isotope rentabler zu gestalten, werden oft verschiedene der nachfolgend angeführten Trennmethoden kombiniert oder mehrfach hintereinandergeschaltet. Dabei multiplizieren sich die Anreicherungsfaktoren der einzelnen Trennstufen.
1) Beim Gasdiffusionsverfahren (Diffusionsverfahren) wird der Unterschied in den Diffusionsgeschwindigkeiten gasförmiger Verbindungen von Isotopen zur I. ausgenutzt. Das Isotopengemisch strömt durch poröse Wände oder in einen Dampfstrahl hinein, wobei das leichtere Isotop dem schwereren vorauseilt, wenn bei niedrigem Druck und kleinem Porendurchmesser die mittlere freie Weglänge der Gasmoleküle in der gleichen Größenordnung liegt wie der Porendurchmesser. Der Trenneffekt muß durch die Anwendung zahlreicher hintereinander angeordneter Trennglieder vervielfacht werden.
2) Bei der Trenndüse nach E. W. Becker macht man von der unterschiedlichen thermischen Geschwindigkeit gasförmiger Isotopengemische Gebrauch. Ein Gasstrahl tritt mit Überschallgeschwindigkeit aus einer Düse aus. Das schwerere Isotop hält sich bevorzugt in Strahlrichtung auf, während das leichtere infolge seiner geringeren Trägheit in seitlicher Richtung etwas leichter aus dem Strahl zu entweichen vermag.
3) Das Clusius-Dickel-Verfahren (Trennrohrverfahren) beruht auf der Erscheinung der Thermodiffusion. Herrscht in einem gasförmigen oder flüssigen Gemisch ein Temperaturgradient, so werden die leichteren Komponenten am heißen, die schweren am kalten Ende angereichert. Die Vervielfachung dieses äußerst kleinen Trenneffekts gelingt durch Kombination der Thermodiffusion mit der Thermokonvektion.
4) Das Schleuderverfahren mit Hilfe der Gaszentrifuge beruht darauf, daß das schwerere Isotop am äußeren Umfang der Zentrifuge angereichert wird, da die Zentrifugalkraft der Masse proportional ist.
5) Zur Trennung der Isotope einiger leichter Elemente wird die Gegenstromdestillation angewandt, die die geringfügigen Dampfdruckunterschiede der Isotope oder ihrer Verbindungen ausnutzt. So kann das schwerere Wasserstoffisotop Deuterium mittels der Tieftemperaturdestillation von verflüssigtem Wasserstoff auch im technischen Maßstab gewonnen werden. Durch Destillation von Wasser (besonders unter vermindertem Druck) werden im Restwasser die Sauerstoffisotope 17O und 18O sowie Deuterium angereichert. In Form der Molekulardestillation hat die Destillation auch für die Trennung der Isotope schwerer Elemente, z. B. des Quecksilbers, Bedeutung erlangt.
6) Bei der Elektrolyse des Wassers wird an der Kathode bevorzugt leichter Wasserstoff abgeschieden, so daß das Deuterium im unzersetzten Rest angereichert wird. Durch Elektrolyse von geschmolzenem Lithiumchlorid LiCl kann 6Li angereichert werden. Der Effekt beruht hier auf den unterschiedlichen Wanderungsgeschwindigkeiten der isotopen Ionen im elektrischen Feld.
7) Großtechnische Bedeutung hat auch das chem. Austauschverfahren erlangt. Es beruht darauf, daß die Gleichgewichtskonstanten K (Massenwirkungsgesetz) von Isotopenaustauschreaktionen vielfach einen merklich von 1 abweichenden Wert haben. So gilt für den Austausch der Stickstoffisotope zwischen gasförmigem Stickstoffmonoxid NO und in Wasser gelöster Salpetersäure HNO3: 15NO + H14NO3![]()
14NO + H15NO3;
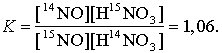
Das schwerere Stickstoffisotop 15N wird also in der flüssigen Phase (in der Salpetersäure) angereichert. Dieser Trenneffekt wird durch einen Gegenstromprozeß vervielfacht. Bei großtechnischen Prozessen zur Gewinnung von Deuterium durch chem. Austausch in Systemen wie Wasserstoff/Wasser, Schwefelwasserstoff/Wasser oder Wasserstoff/Ammoniak kann die (in diesen Fällen unwirtschaftliche) Phasenumwandlung durch die Anwendung des Heiß-Kalt-Verfahrens umgangen werden, das auf der Temperaturabhängigkeit solcher Isotopenaustausch-Gleichgewichte beruht. Der Wasserstoff-Wasser-Austausch muß durch einen im Wasser suspendierten Katalysator, z. B. Platin auf Aktivkohle, beschleunigt werden.
8) Eine nahezu vollständige Trennung der Isotope tritt im Massenspektrometer (Massenspektroskopie) ein. Da jedoch bei den üblichen Apparaten die Mengen, die von den einzelnen Isotopen erhalten werden, unwägbar klein sind, wurden besonders intensitätsstarke Geräte (Massenseparatoren) entwickelt, mit denen Isotope auch in wägbaren Mengen getrennt werden können.
9) Mit der Entwicklung leistungsstarker und abstimmbarer Laser wird eine weitere Methode der I. möglich. Durch die monochromatische Laserstrahlung wird infolge der isotopieabhängigen Verschiebung der Spektrallinien nur ein bestimmtes Isotop angeregt. Die betreffenden Atome werden dann vom übrigen Isotopengemisch abgetrennt.
Die Verfahren zur I. nach 1) bis 7) sind statistische Verfahren, bei denen eine gemittelte Wirkung auftritt, die nach 8) und 9) sind nichtstatistische Verfahren; letztere lassen theoretisch schon mit einer einstufigen Anlage eine fast völlige Trennung zu.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.