Lexikon der Chemie: Metallcarbonyle
Metallcarbonyle, im engeren Sinn binäre Kohlenmonoxidkomplexe nullwertiger Übergangsmetalle, wobei stabile M. bisher nur mit Metallen der VI.-VIII. Nebengruppe (außer Pd, Pt) sowie mit Vanadium bekannt sind. Man unterscheidet ein- und mehrkernige M. Einkernige M. werden unter Befolgung der 18-Elektronen-Regel durch Chrom, Molybdän und Wolfram als oktaedrische Verbindungen des Typs M(CO)6, durch Eisen, Ruthenium und Osmium als trigonal-bipyramidale Komplexe des Typs M(CO)5 sowie durch Nickel als tetraedrisches Ni(CO)4 gebildet. Im Gegensatz zu den genannten diamagnetischen M. ist das oktaedrische V(CO)6 ein paramagnetischer Komplex mit einem ungepaarten Elektron. Als einfachste mehrkernige M. (Abb.) bilden Cobalt sowie Mangan, Technetium und Rhenium Zweikerncarbonyle: Co2(CO)8; M2(CO)10 (M: Mn, Tc, Re). Während für Octacarbonyldicobalt(0) in Lösung Bindungsisomere gemäß (a, b) nachgewiesen werden können, sind für die genannten Decacarbonyldimetall(0)-Komplexe, M2(CO)10, gemäß (c) CO-Brücken auszuschließen. Eisen bildet ein Zweikerncarbonyl, Fe2(CO)9, in dem gemäß (d) drei verbrückende CO-Gruppen vorliegen. Unter den Dreikerncarbonylen des Typs M3(CO)12 weisen diejenigen des Rutheniums und Osmiums eine trigonale Struktur mit ausschließlich terminal gebundenen CO-Liganden auf (e), während das Fe3(CO)12 durch unsymmetrische Struktur (f) charakterisiert ist. Vierkerncarbonyle, M4(CO)12, sind für M = Co, Rh und Ir bekannt. Bei diesen Metallen kennt man auch sechskernige M., für M = Os auch fünf- bis achtkernige M.
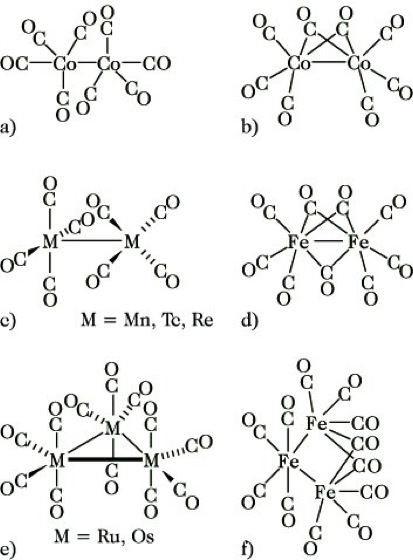
Metallcarbonyle. Abb.: Strukturtypen wichtiger Mehrkerncarbonyle.
M. im weiteren Sinn sind neutrale Carbonylderivate des Typs M(CO)nLm sowie kationische und anionische Carbonylkomplexe. Beispiele für homoleptische kationische M. stellen die oktaedrischen Kationen [M(CO)6]n+ (n = 1: Mn, Tc, Re; n = 3: M = Ir), die quadratisch-planaren Species [M(CO)4]+ (M = Pd, Pt) sowie die linearen Systeme [M(CO)2]+ (M = Ag, Au, Hg) dar. Einkernige und vor allem mehrkernige Carbonylmetallate des Typs [Mn(CO)m]z- sind von allen Metallen der IV.-VIII. Nebengruppe bekannt und zeigen eine reiche Strukturvielfalt.
M. sind einer Vielzahl von Reaktionen zugänglich. So erhält man durch die reduktive Basenreaktion der M. Metallcarbonylwasserstoffe (Metallcarbonylhydride), z. B. gemäß Fe(CO)5 + 2 NaOH → Na[HFe(CO)4] + H+ → H2Fe(CO)4 + Na+.
Durch Reduktion von M. mit Alkalimetallen entstehen Alkalimetallcarbonylmetallate, so z. B. gemäß Mn2(CO)10 + 2 Li → 2 Li[Mn(CO)5]. Metallcarbonylwasserstoffe sind schwache Säuren, wie die pK-Werte z. B. von Mangancarbonylwasserstoff HMn(CO)5 (pK ≈ 7) oder Eisencarbonylwasserstoff H2Fe(CO)4 (pK1 ≈ 4; pK2 ≈ 13) belegen. Mit Halogenen lassen sich mehrkernige M. zu Metallcarbonylhalogeniden oxidieren, z. B.: Mn2(CO)10 + Br2 → 2 MnBr(CO)5. Metallcarbonylhalogenide sind auch durch direkte Umsetzung von Metallhalogeniden mit Kohlenmonoxid zugänglich, z. B. gemäß 2 PtCl2 + 2 CO → [PtCl2(CO)]2. Über die Bindungsverhältnisse von M. Koordinationschemie.
Die Gewinnung der M. erfolgt z. T. durch direkte Reaktion der Metalle mit Kohlenmonoxid, z. B. gemäß Ni + 4 CO → Ni(CO)4 bei erhöhter Temperatur, oder häufiger durch reduktive Carbonylierung, z. B. gemäß OsO4 + 9 CO → Os(CO)5 + 4 CO2; WCl6 + 3 Fe(CO)5 → W(CO)6 + 3 FeCl2 + 9 CO; 2 CoCO3 + 2 H2 + 8 CO → Co2(CO)8 + 2 CO2 + 2 H2O. Mehrkerncarbonyle bilden sich durch Photolyse- oder Thermolysereaktionen aus einfacheren binären M., z. B. gemäß:
2 Fe(CO)5![]()
Fe2(CO)9 + CO;
2 Co2(CO)8![]()
Co4(CO)12 + 4 CO.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.