Lexikon der Ernährung: Porphyrinstoffwechsel
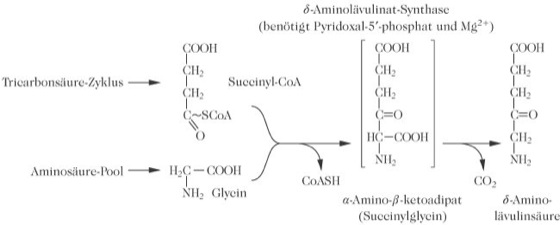
Porphyrinstoffwechsel, Eporphyrinmetabolism, ist prinzipiell in allen Zellen mit aerobem Stoffwechsel möglich. Im menschlichen Körper findet der wesentliche Teil in Zellen des Knochenmarks (85 %) und der Leber statt. Der P. läuft teilweise im Mitochondrium und partiell im Cytosol ab. Ausgehend von Succinyl-CoA, einem Zwischenprodukt des mitochondrialen Tricarbonsäure-Zyklus, wird durch Kondensation mit der Aminosäure Glycin α-Amino-β-ketoadipat gebildet, das dann zu δ-Aminolävulinsäure decarboxyliert wird. Die Reaktion wird von der δ-Aminolävulinsäure-Synthase katalysiert (Abb. 1). Zwei Moleküle δ-Aminolävulinat kondensieren anschließend durch die katalytische Wirkung der Porphobilinogen-Synthase zu Porphobilinogen (Abb. 2). Dieses kondensiert durch die enzymatische Wirkung der Porphobilinogen-Desaminase in einer Kopf-Schwanz-Reaktion mit drei weiteren Porphobilinogenmolekülen zum instabilen Zwischenprodukt Hydroxymethylbilan, einem linearen Tetrapyrrol. Durch die Uroporphyrinogen-III-Synthase wird das enzymgebundene lineare Tetrapyrrol zyklisiert und intramolekular zum asymmetrischen Uroporphyrinogen III umgelagert. Am Pyrrolring D findet ein Austausch der Acetat- und Propionatseitenketten statt. Parallel entsteht unter physiologischen Bedingungen auf nicht enzymatischem Weg durch einen spontanen Ringschluss eine sehr geringe Menge Uroporphyrinogen I. Heptacarboxy-, Hexacarboxy-, Pentacarboxy- und Coproporphyrinogen I und III werden sukzessive durch Decarboxylierung der Acetatseitenketten aller vier Pyrrolringe unter dem Einfluss der Uroporphyrinogen-Decarboxylase gebildet. Die Porphyrinogene vom Typ Isomer I haben keine physiologische Funktion und werden in oxidierter Form als Porphyrine, entsprechend ihrer Wasserlöslichkeit mit Urin und Stuhl ausgeschieden.
Im Mitochondrium katalysiert die Coproporphyrinogen-Oxidase, ein für Coproporphyrinogen III spezifisches Enzym, die Bildung von Protoporphyrinogen IX, wobei die Propionatseitenketten der Ringe A und B zu Vinylseitenketten dehydriert und decarboxyliert werden (Abb. 3). Durch eine weitere Oxidation wird die Hämvorstufe Protoporphyrin IX gebildet. Die Protoporphyrinogen-Oxidase katalysiert dabei die Dehydrierung der die einzelnen Ringe verbindenden Methylengruppen zu Methinbrücken. Aus diesem Porphyrinring entsteht durch Chelatbildung mit zweiwertigem Eisen das Häm, die prostetische Gruppe von Proteinen wie Hämoglobin, Myoglobin, Katalasen, Peroxidasen und Cytochromen. Den Einbau des zweiwertigen Eisens katalysiert die Ferrochelatase. Zur Biosynthese von Häm werden jeweils acht Moleküle Glycin und Succinyl-CoA benötigt.
Der Ablauf des P. ist im Knochenmark und in der Leber identisch. Die funktionellen Eigenschaften einzelner Enzyme unterscheiden sich jedoch durch die Existenz von gewebespezifischen Isoformen. Diese haben für die unterschiedliche Regulation des P. in Leber und Knochenmark eine große Bedeutung. In den Leberzellen ist die δ-Aminolävulinsäure-Synthase das Schlüsselenzym, dessen Aktivität über eine negative Rückkopplung von Häm, dem Endprodukt der Hämbiosynthese, reguliert wird. Das Häm wirkt über Hemmung der Enzymneusynthese, Beeinflussung des Transportes vom cytosolischen Proenzym in das Mitochondrium sowie über eine allosterische Hemmung der Enzymaktivität. Von Bedeutung für die Regulation der Hämbiosynthese ist die Konzentration des Häms in der Zelle, die nicht nur von der Synthese, sondern auch vom Einbau in Hämproteine bestimmt ist. Eine Stimulierung der δ-Aminolävulinsäure-Synthase kann somit indirekt über Substanzen, die die Synthese des Hämproteins Cytochrom P450 induzieren (z. B. Barbiturate), erfolgen. Dies erklärt auch die Induktion der δ-Aminolävulinsäure-Synthase bei den akuten Porphyrien. Solche Störungen des P. sind erblich bedingt.
Porphyrinstoffwechsel: Abb. 1. Der Geschwindigkeits-bestimmende Schritt der Porphyrinsynthese, katalysiert durch das Enzym δ-Aminolävulinsäure-Synthase. Die Zwischenverbindung in Klammern (Succinylglycin) wurde nicht zweifelsfrei nachgewiesen. Kondensation und Decarboxylierung können gleichzeitig ablaufen. Porphyrinstoffwechsel
Porphyrinstoffwechsel: Abb. 2. Schritte der Pophyrinsynthese, die im Cytoplasma der Leberzellen ablaufen. Coproporphyrin wird in konstanten, jedoch geringen Mengen im Harn (40–190 mg / d) und im Stuhl (300–1.100 mg / Tag) ausgeschieden. Diese Raten nehmen bei hämolytischen Störungen zu. Die weitere Umwandlung von Coproporphyrinogen III findet in den Mitochondrien der Leberzellen statt (Abb. 3). Zur Nummerierung des Porphyrinringsystems vgl. Abb. 3. Porphyrinstoffwechsel

Porphyrinstoffwechsel: Abb. 3. Die letzten Schritte der Synthese von Protoporphyrin III und dessen Überführung in Häm. Ein genetischer Defekt der Ferrochelatase führt zum Krankheitsbild der Protoporphyrie. Die Zahlen in Klammern und die griechischen Buchstaben entsprechen dem Fischersystem, die nicht eingeklammerten Zahlen geben das Nummerierungssystem 1–24 des Porphyrinrings wieder. Porphyrinstoffwechsel

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.