Lexikon der Chemie: Aminosäuren
Aminosäuren, Aminocarbonsäuren, Carbonsäuren mit einer oder mehreren Aminogruppen -NH2, die entsprechend ihrer Position zur Carboxylgruppe als α-, β-, γ- oder ω-A. bezeichnet werden.
Von den über 500 in der Natur vorkommenden A. sind die am Aufbau der Proteine beteiligten und in Nucleinsäuren kodierten α-A. (proteinogene A., Tab. 1) besonders wichtig. Sie besitzen mit Ausnahme von Gly am α-Kohlenstoffatom ein Chiralitätszentrum mit L-Konfiguration [nach der Cahn-Ingold-Prelog-Konvention (Stereoisomerie 1.1) S-Konfiguration außer Cys] und sind optisch aktiv. Die Seitenketten von Thr und Ile enthalten ebenfalls chirale Zentren. D-A. finden sich u. a. als Zellwandbaustein von Bakterien und Bestandteil verschiedener Antibiotika. Die vielfach verwendeten Dreibuchstabensymbole der proteinogenen A. sind gewöhnlich aus den ersten 3 Buchstaben ihres Trivialnamens zusammengesetzt. Die natürliche Konfiguration ist dabei im Symbol nicht enthalten (Ala für L-Alanin), nur D- und dl-A. werden besonders gekennzeichnet (D-Ala für D-Alanin, dl-Ala für dl-Alanin).
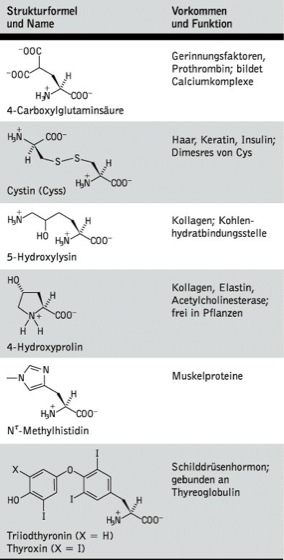
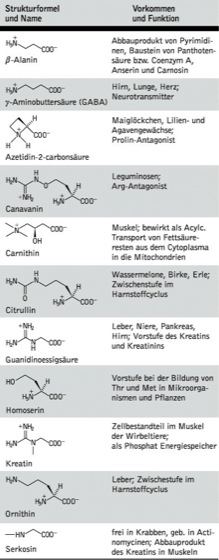
Außer den 20 proteinogenen A. wurden in bestimmten Proteinen auch andere A. gefunden, die durch chemische Modifikation der A.reste fertiger Proteine entstehen (posttranslationell veränderte A.; Tab. 2) und wichtige Funktionen in Enzymen, Hormonen und anderen Proteinen wahrnehmen. Neben ihrer Rolle als Proteinbausteine fungieren A. als Intermediate des Stoffwechsels, Neurotransmitter, Antagonisten und Gifte (nichtproteinogene A.; Tab. 3). Sie sind häufig Stoffwechselprodukte von Pflanzen und Mikroorganismen; einige üben auch im menschlichen und tierischen Organismus spezifische Funktionen aus.
Einteilung. Die proteinogenen A. werden nach den Polaritäten ihrer Seitenketten eingeteilt, die für die intra- und intermolekularen Wechselwirkungen bei Proteinen und damit für deren Eigenschaften entscheidend sind. Man unterscheidet 3 Haupttypen (Tab. 1): A. mit unpolaren Seitenketten, A. mit polaren, ungeladenen (neutralen) Seitenketten und A. mit polaren, geladenen (sauren oder basischen) Seitenketten. Die unpolaren A. sind für die Ausbildung hydrophober Wechselwirkungen im Inneren von Proteinstrukturen wichtig. Die polaren A. befinden sich gewöhnlich an der Proteinoberfläche und vermitteln deren Wasserlöslichkeit, in einigen Fällen sind sie im Inneren des Moleküls an der Ausübung chemischer Reaktionen (Katalyse, Bildung von Metall-Ionen) beteiligt. Cys kann Disulfidbrücken ausbilden (Cystin) und somit erheblich zur Proteinstabilisierung beitragen.
Eigenschaften. A. mit einer basischen Amino- und einer sauren Carboxylgruppe sind amphoter, ihre Lösungen sind Ampholyte. Im festen Zustand und in neutraler wäßriger Lösung liegen A. als innere Salze (Zwitterionen) mit protonierter Amino- und deprotonierter Carboxylgruppe vor, was ihre hohen Schmelzpunkte sowie ihre meist gute Wasserlöslichkeit (Tab. 1) erklärt. In den meisten organischen Lösungsmitteln sind A. unlöslich, lediglich Cys und Pro lösen sich in Ethanol. Mit Säuren oder Basen reagieren A. unter Aufnahme bzw. Abgabe eines Protons gemäß
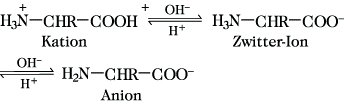
so daß A. in saurer Lösung (pH < 4) als Ammonium-Kation, in alkalischer Lösung (pH > 9) als Carboxylat-Anion vorliegen. Alle A. können in ihrem Säure-Base-Verhalten durch die zur α-Amino-, α-Carboxyl- oder zur entsprechenden Seitenkettenfunktion gehörenden Dissoziationskonstanten (K1, K2 oder KR) charakterisiert werden, die meist als pK-Werte (pK = -log K) ausgedrückt werden (Tab. 1). Der pH-Wert, bei dem A. als Zwitterionen vorliegen, entspricht dem isoelektrischen Punkt pHI (Tab. 1). Er ist für neutrale A. als arithmetisches Mittel der pK1- und pK2-Werte, für saure A. als arithmetisches Mittel der pK1- und pKR-Werte und für basische A. als arithmetisches Mittel der pK2- und pKR-Werte definiert. Löslichkeit und spezifische Drehung [α]D durchlaufen am pHI ein Minimum. Im Bereich der pK-Werte (pH 1-3 und pH 8,5-10,5) können A. als Puffer wirken. Im physiologischen pH-Bereich 6-8 zeigt unter den proteinogenen A. nur His Pufferkapazität. Gegenüber den entsprechenden Carbonsäuren ist bei A. die Acidität der Carboxylgruppe infolge des -I-Effektes der Ammoniumgruppe größer (pK Essigsäure 4,76; pK1 Gly 2,34) und die Basizität der Aminogruppe infolge des -I-Effektes der Carboxylatgruppe geringer (pK Ethylamin 10,75; pK2 Gly 9,60).
Analytisches. Die analytische Bestimmung von A. erfolgt heute v. a. durch Hochleistungsflüssigchromatographie. Dabei wird das A.gemisch direkt durch Ionenaustauschchromatographie oder nach Derivatisierung durch Umkehrphasenchromatographie analysiert. Das Verfahren wird automatisiert in A.analysatoren durchgeführt. Nachweis und Quantifizierung der A. erfolgt durch photometrische Messung nach Anfärbung mit Ninhydrin oder fluorimetrische Bestimmung nach Umsetzung zu fluorescierenden A.derivaten. Bei der Ninhydrinreaktion wird ein blauvioletter Farbstoff (λmax 570 nm, außer Pro: 440 nm) gebildet. Die Reaktion von A. mit o-Phthaldialdehyd (OPA) und Reduktionsmitteln führt zu fluorescierenden Isoindolderivaten (λex 330 nm, λem 455 nm). 4-Phenyl-[furan-2H(3H)-1'-phthalan]-3,3'-dion (Fluorescamin) bildet mit A. stark fluoreszierende Pyrrolidone (λex 390 nm, λem 474 nm). 5-Dimethylaminonaphthalin-1-sulfonsäurechlorid (Dansyl-Cl) und 9-Fluorenylmethylchlorformiat (Fmoc-Cl) liefern fluorescierende Dansyl-A. (λex 335 nm, λem 578 nm) bzw. Fmoc-A. (λex 260 nm, λem 310 nm), die für eine säulenchromatographische Trennung und Bestimmung geeignet sind. Phenylisothiocyanat (Edman-Abbau) wird v. a. zur Identifizierung N-terminaler A. bei der A.sequenzanalyse von Proteinen eingesetzt. Die aromatischen A. zeigen charakteristische UV-Absorptionen (Phe 257 nm, Tyr 274 nm, Trp 280 nm) und bilden damit die Basis zur qualitativen bzw. halbquantitativen Bestimmung von Proteinen. Tyr (λex 280 nm, λem 303 nm) und insbesondere Trp (λex 280 nm, λem 348 nm) sind aufgrund ihrer Eigenfluoreszenz selektiv fluorimetrisch analysierbar.
Reaktionen. A. zeigen die üblichen Reaktionen von Carbonsäuren und Aminen. Von praktischer Bedeutung für die Peptidsynthese sind die Acylierung zu N-Acyl-A., die Veresterung zu A.estern sowie die amidartige Verknüpfung von A. (Peptidkupplung). Weitere charakteristische Reaktionen sind die N-Alkylierung, die Komplexbildung mit Metall-Ionen, die Diazotierung, die Decarboxylierung zu biogenen Aminen, die Desaminierung sowie die Transaminierung.
Physiologie und Biochemie. Mensch und Säugetier können im Gegensatz zu Pflanzen und Mikroorganismen nur 10 proteinogene A. (die nichtessentiellen A. Ala, Asp, Asn, Cys, Glu, Gln, Gly, Hyp, Pro, Ser und Tyr) selbst aufbauen. Die übrigen A. müssen mit der Nahrung zugeführt werden (essentielle A., Abk. EAS), wenn es nicht zu lebensbedrohlichen Mangelerscheinungen (Wachstumsverzögerung, Störung der Proteinbiosynthese, negative Stickstoffbilanz) kommen soll. Als Tagesmindestbedarf an EAS gelten für Erwachsene: Arg 1,8 g, His 0,9 g, Ile 0,7 g, Leu 1,1 g, Lys 0,8 g, Met 1,1 g, Phe 1,1 g, Thr 0,5 g, Trp 0,25 g und Val 0,8 g. Arg und His sind semiessentielle A., die vom Organismus nur begrenzt synthetisiert werden können und besonders in Wachstumsphasen erforderlich sind. Der EAS-Bedarf ist vom Alter und physiologischen Zustand abhängig. In der Schwangerschaft steigen der Trp- und der Lys-Bedarf. Säuglinge und Kinder benötigen bezogen auf das Körpergewicht erheblich mehr EAS als Erwachsene.
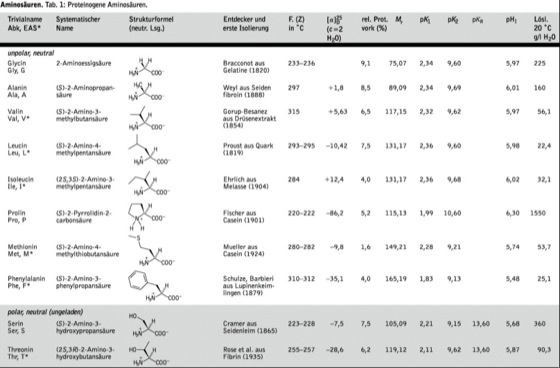
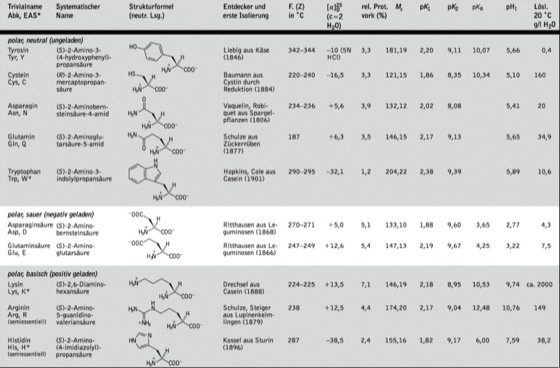
Aminosäuren. Tab. 2: Posttranslationell veränderte Aminosäuren.
Die Nahrungsproteine werden bei der Verdauung im Magen-Darm-Trakt über Peptide zu den A. zerlegt, die resorbiert werden und in den Blutstrom gelangen. Dort bilden sie einen Pool freier A., die einerseits für den Aufbau neuer körpereigener Proteine dienen oder aber im Stoffwechsel weiter ab- und umgebaut werden. Beim Abbau werden die A. in einem ersten transaminierenden Schritt zu den entsprechenden α-Ketosäuren umgewandelt, wobei der Aminostickstoff auf α-Ketoglutarat unter Bildung von Glutamat übertragen wird. Glutamat kann durch oxidative Desaminierung mittels Glutamat-Dehydrogenase zu Ammoniak und α-Ketoglutarat gespalten werden. Je nach Art der entstehenden Ketosäuren werden A. in glucogene (glucoplastische) oder ketogene (ketoplastische) A. unterteilt. Glucogene A. (Ala, Arg, Asp, Asn, Cys, Glu, Gln, Gly, His, Met, Pro, Ser, Thr, Val) bilden nach Transaminierung Zwischenprodukte des Citronensäurecyclus oder können über den Gluconeogenese-Weg in Kohlenhydrate (Glucose, Glycogen) umgewandelt werden. Die ketogenen A. (Leu, Lys) liefern beim Abbau Acetyl-Coenzym A (darüber Umwandlung in Fettsäuren) oder nicht weiter verwendbare Ketonkörper (Acetessigsäure, Aceton). Eigene A. (Trp, Phe, Tyr, Ile) können beiden Gruppen zugeordnet werden. Die Biosynthese der proteinogenen A. erfolgt durch Transaminierung der entsprechenden α-Ketosäuren mit Glutamat als Aminogruppen-Donor. Beim Aufbau des Kohlenstoffgerüstes unterscheidet man verschiedene Biosynthese-Familien, die von unterschiedlichen Grundbausteinen ausgehen: Arg, Gln, Glu, Pro von α-Ketoglutarat (Glutamat-Familie); Asn, Asp, Ile, Met, Lys, Thr von Oxalacetat (Aspartat-Familie); Cys, Gly, Ser von 3-Phosphoglycerat (Serin-Familie); Ala, Leu, Val von Pyruvat (Pyruvat-Familie); Phe, Trp, Tyr von Phosphoenolpyruvat und Erythrose-4-phosphat (Aromaten-Familie) und schließlich His von Phosphoribosylpyrophosphat und ATP.
Gewinnung. A. können durch Isolierung aus Proteinhydrolysaten, durch Chemosynthese sowie biotechnologisch auf mikrobiellem und enzymatischem Weg gewonnen werden. Die Hydrolyse von Proteinen wird durch Kochen mit Salz- oder Schwefelsäure oder durch Einwirkung proteolytischer Enzyme durchgeführt. Bei der Säurehydrolyse wird Trp vollständig und Ser/Thr bis zu 10 % zerstört. Aus dem Hydrolysat werden die schwerlöslichen A. durch Neutralisation gefällt und die wasserlöslichen A. chromatographisch getrennt.
Unter der Vielzahl der Chemosyntheseverfahren von A. (Ammonolyse von Halogencarbonsäuren, Malonester-; Erlenmeyer-Synthese) haben besonders die Strecker- und Bucherer-Synthese zu wirtschaftlichen Verfahren geführt. Bei der Strecker-Synthese werden Aldehyde mit Blausäure und Ammoniak über Cyanhydrine zu Aminonitrilen umgesetzt, deren hydrolytische Spaltung dl-A. ergibt. Nach der Bucherer-Synthese wird das intermediär gebildete Cyanhydrin mit Ammoniak und Kohlendioxid zum Hydantoin umgesetzt, das zur A. verseift wird. Die Strecker-Synthese wird industriell zur Gewinnung von A. mit leicht zugänglichem Ausgangsaldehyd eingesetzt (Met). Da bei der Chemosynthese stets die dl-A. entstehen, ist eine Enantiomerentrennung durch Umsetzung mit optisch aktiven Hilfsstoffen zu diastereomeren Salzen und deren fraktionierte Kristallisation oder durch enantioselektive Hydrolyse von A.derivaten (Acetyl- und Chloracetyl-A. oder A.ester) mit Hilfe immobilisierter Acylasen und Esterasen erforderlich. Die Enantiomerentrennung entfällt bei der asymmetrischen Synthese von A., bei der z. B. durch enantioselektive Hydrierung von α,β-Dehydro-A. R-CH=C(NH2)-COOH in Gegenwart chiraler Rhodium-Komplexe A. in relativ hoher optischer Reinheit gewonnen werden können.
Alle proteinogenen A. können biotechnologisch hergestellt werden. Man unterscheidet die mikrobielle Fermentation, bei der mutierte oder rekombinierte Mikroorganismen bestimmte A. über den Eigenbedarf hinaus produzieren und Biotransformationen, bei denen immobilisierte Enzyme oder Mikroorganismen spezielle, enantioselektive Reaktionsschritte katalysieren. Durch Fermentation werden heute v. a. Glu, Trp und Lys gewonnen. Beispiele für Biotransformationen sind die Herstellung von Asp durch stereospezifische Addition von Ammoniak an Fumarsäure und die β-Decarboxylierung von Asp zu Ala.
Weltweit werden gegenwärtig 900000 t A. produziert, davon der größte Anteil mit biotechnologischen Methoden. An der Spitze steht die Herstellung von Glu (ca. 450000 t), gefolgt von dl-Met (ca. 220000 t) und Lys (ca. 80000 t).
Verwendung. Essentielle A. (Lys, Met, Thr, Trp) werden für die Supplementierung von Futtermitteln in der Tierernährung und für die Qualitätsverbesserung pflanzlicher Proteine (Reis, Mais, Weizen) in der menschlichen Ernährung eingesetzt. Natriumglutamat und Cys dienen in der Lebensmitteltechnologie als Geschmacks- und Würzstoffe. In der Medizin werden A. für chemisch definierte Diäten bei Störungen des A.- und Fettstoffwechsels sowie für Infusionslösungen zur parenteralen Ernährung verwendet. A. dienen auch als Zusatzstoff von Hautcremes, Shampoos und anderen Kosmetika sowie als Ausgangsstoff für die Synthese von Therapeutika und Peptidwirkstoffen.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.