Lexikon der Biologie: Membranproteine
Membranproteine, Proteine, die Bestandteile biologischer Membranen sind und den verschiedenen zellulären Membranen ihre Spezifität verleihen. Einheitliche „Strukturproteine“, wie sie früher vielfach angenommen wurden, gibt es nicht. Die Grundstruktur aller Biomembranen bildet eine Lipiddoppelschicht (bimolekulare Lipidschicht). Membranproteine sind für die meisten spezifischen Funktionen einer Membran, z.B. Transport von Substanzen (Membrantransport), Herstellung von Zell-Zell-Kontakten (junctions), Zell-Zell-Erkennung und Kontakt zum Cytoskelett (Zellskelett), verantwortlich. Sie können auch als Enzyme, meist innerhalb eines Multienzymkomplexes, oder als Rezeptor fungieren. Man unterscheidet 2 Klassen von Membranproteinen: die den Membranen mehr oder weniger stark oberflächlich assoziierten peripheren oder extrinsischen Membranproteine und die in der Lipidschicht verankerten oder durch sie hindurchreichenden integralen oder intrinsischen Membranproteine. Die peripheren Membranproteine sind über elektrostatische Kräfte und Wasserstoffbrücken an die Membran bzw. an integrale Proteine gebunden und können relativ leicht von der Membran abgelöst werden, z.B. durch drastische Veränderung des Ionenmilieus, durch Chelatoren zweiwertiger Kationen (z.B. EDTA = Ethylendiamintetraacetat), durch Waschen der Membranen mit destilliertem Wasser oder allein schon durch die Aufarbeitung (Homogenisation; homogenisieren) des Gewebes. Sie sind also dadurch gekennzeichnet, daß sie funktionell mit der Membran in Zusammenhang stehen, jedoch – im Gegensatz zu den integralen Membranproteinen – meist keine hydrophoben Wechselwirkungen mit ihr eingehen. Viele am Lipidstoffwechsel (Fettstoffwechsel) beteiligte Enzyme, die mit ihren meist lipophilen Substraten und Produkten in enger Wechselwirkung mit Membranen stehen, gehören zur Gruppe der peripheren Membranproteine, ebenso das am Elektronentransport in der inneren Mitochondrienmembran (Mitochondrien) beteiligte Cytochrom c (Cytochrome, Atmungskette). Die peripheren Membranproteine können etwa 1/4 der Proteine einer Membran ausmachen. – Bei den integralen Membranproteinen (ca. 3/4 der Membranproteine) spielen hydrophobe Wechselwirkungen mit den Membranlipiden eine entscheidende Rolle. Sie können nur mit Hilfe von Detergentien ( vgl. Abb. 1 ) aus der Membran herausgelöst („solubilisiert“) werden. Solche integralen Membranproteine können durch die Membran hindurchtreten (als Transmembranproteine) oder fest mit der Membran verankert sein (Proteolipide, Lipophilin), z.B. mittels kovalenter Verknüpfung durch eine Fettsäurekette (z.B. Myristinsäure, Palmitinsäure) oder eine Prenylgruppe (Farnesylgruppe, Geranylgruppe). Die innerhalb der Membran befindlichen Bereiche eines Membranproteins liegen dort hauptsächlich in Form der Alpha-Helix, seltener als Beta-Faltblatt (Porine) vor ( vgl. Abb. 2 ). Die im hydrophoben Innern der Membranen angeordneten Abschnitte weisen ein besonderes Aminosäuremuster auf; es überwiegen dort solche Aminosäuren, die hydrophobe und unpolare Reste tragen, z.B. Alanin, Phenylalanin, Leucin, Isoleucin, Valin und Threonin. Bei dieser α-helicalen Struktur, der sog. hydrophoben Helix, weisen die Aminosäurereste nach außen und gehen hydrophobe Wechselwirkungen mit den Membranlipiden ein. (Im Gegensatz dazu sind die hydrophoben Aminosäuren eines löslichen Proteins oft in der Sequenz verstreut angeordnet und werden erst durch die Proteinfaltung zusammengelagert.) Da Wasser von der Lipiddoppelschicht so gut wie ausgeschlossen ist, können die integralen Proteine keine Wasserstoffbrücken-Bindungen zum Wasser, sondern nur intramolekular ausbilden; dabei entstehen die genannten Sekundärstrukturen. Nur ein relativ kleiner Anteil eines Membranproteins (pro „Membrandurchgang“ 20–25 Aminosäuren) ist im hydrophoben Bereich der Membran lokalisiert. Der weitaus größere Teil ist zu den angrenzenden hydrophilen Bereichen des Cytoplasmas bzw. des extraplasmatischen (extrazellulären) Raums hin exponiert. Der hydrophoben Sequenz folgen oft auf der P-Seite der Membran einige positiv geladene Aminosäuren, die mit negativ geladenen Phospholipiden interagieren. Vom Rhodopsin in den Disc-Membranen (Disc) des äußeren Segments der Stäbchenzelle der Retina (Netzhaut) und vom Anionentranslokator der Erythrocyten-Plasmamembran (Erythrocyten) liegen je etwa 20% im hydrophoben Membraninnern. Eine Ausnahme bildet das Bakteriorhodopsin (248 Aminosäuren), eine Protonenpumpe in bestimmten funktionellen Bereichen der Plasmamembran (Purpurmembran) halophiler Bakterien. Bei diesem Membranprotein sind ca. 50% des Proteins im hydrophoben Membraninnern lokalisiert. Dabei durchspannt es die Membran in 7 (senkrecht zur Membranebene verlaufenden) α-helicalen Bereichen (Bakteriorhodopsin [Abb.]), während das Glykoprotein Glykophorin (131 Aminosäuren) z.B. die Erythrocytenmembran nur 1mal durchquert. Der Glucose-Translokator (492 Aminosäuren) der Erythrocytenmembran durchquert die Membran 12mal, und die spannungsabhängigen Ionenkanäle für Na+ (Natriumkanäle) und Ca2+ (Calciumkanäle) sogar 24 mal (4·6). Ionenkanäle werden häufig durch mehrere amphipathische Helices (amphipathische Helix) gebildet, deren hydrophobe Aminosäurereste zur Lipidphase und hydrophile Reste zum hydrophilen Kanalinnern zeigen. Die Selektivität des Acetylcholinrezeptors für Kationen beruht z.B. auf negativ geladenen Aminosäureseitenketten, die zur Pore weisen. Diese negativen Ketten der 5 Untereinheiten des Rezeptors ergänzen sich zu einem Ring. Aus der Aminosäuresequenz der Proteine lassen sich heute unter Annahme von Hydrophobizitätswerten (Hydrophobizität) Hydropathie-Profile (Hydropathiediagramm) errechnen, die bei der Klärung der Struktur hilfreich sein können. – Nicht nur die Membranlipide können relativ frei in der Membran diffundieren (Membran, Membranfluidität), auch die Membranproteine unterliegen einer regen lateralen und Rotationsdiffusion ( vgl. Abb. 3 ), wie Untersuchungen an den Membranen der Stäbchenzelle für das Rhodopsin ergeben haben (z.B. lateraler Diffusionskoeffizient: 4·10–9 cm2·s–1 bei 20 °C). Dabei werden die Proteine durch die Bestandteile des Membranskeletts in ihrer Bewegungsfreiheit eingeschränkt oder sogar von diesen, vergleichbar einer Choreographie, gelenkt. Nur wenige Proteine diffundieren (Diffusion) völlig frei, andere verharren an einem Ort, bilden Gruppen, die sich bald wieder auflösen, und formieren sich an anderer Stelle neu. Beispiele hierfür sind der epidermale Wachstumsfaktor (epidermal growth factor) und Cadherine (zelluläre Kontaktmoleküle). Die Grenzen der Sammelplätze scheinen mit der Anordnung der Proteinstränge des Membranskeletts übereinzustimmen. Viele Rezeptormoleküle können ihre Funktion der Signalweitergabe ins Zellinnere (Signaltransduktion) nur erfüllen, wenn sie sich zuvor zu Paaren zusammengefunden haben. Der Einfluß des Membranskeletts auf diese gezielten Bewegungen wird noch untersucht. – Die meisten Membranproteine werden vermutlich direkt am rauhen endoplasmatischen Reticulum synthetisiert und über den Golgi-Apparat in die verschiedenen Kompartimente verteilt. Wie bei den Exportproteinen (Exportproteinsynthese, docking protein) muß eine aminoterminale Insertions-Signalsequenz die vektorielle Translation einleiten. Im Gegensatz zu einem Exportprotein soll das Membranprotein jedoch in der Membran verbleiben, so daß ein zusätzliches Stopsignal (eine hydrophobe Aminosäuresequenz, die sich dann zur α-Helix anordnet; Stop-Transfer-Sequenz) existieren muß. Aus ihrer Biogenese wird ersichtlich, daß Membranproteine (Typ-I-Membranproteine) ihr aminoterminales Ende (Aminoterminus) meist auf der E-Seite, ihr Carboxylende (Carboxylterminus) auf der P-Seite der Membran tragen. Man unterscheidet außerdem noch Typ-II-Membranproteine, die mit dem Carboxylende zur E-Seite zeigen, z.B. der Anionentranslokator, und Typ-III-Membranproteine, die mehrere Membrandurchgänge mit unterschiedlichen Orientierungen zeigen. Beispielsweise weist der Glucose-Translokator der Erythrocytenmembran eine geradzahlige Anzahl von Durchgängen auf und weist mit beiden Enden zur E-Seite. Die Topologie dieser Mehrspann-Transmembranproteine wird durch die Kombination von Start- und Stop-Transfersignalen bestimmt: eine Start-Transfer-Sequenz leitet die Translokation durch die Membran ein, die solange fortschreitet, bis ein Stop-Transfer-Signal erreicht wird. Eine weitere Start-Transfer-Sequenz initiiert eine weitere Translokation – wiederum bis zum Abbruch. Dieser Prozeß kann mehrmals stattfinden; Rhodopsin z.B. durchdringt die Membran 7mal. Dementsprechend zeigt das Hydropathiediagramm 7 kurze hydrophobe Bereiche an. Die Zuckerseitenketten der integralen Glykoproteine der Plasmamembran liegen ausschließlich auf der E-Seite. – Über die Topologie der intrinsischen Membranproteine hat man die wesentliche Erkenntnisse mit Hilfe der Gefrierbruch- und Gefrierätzelektronenmikroskopie gewonnen (Gefrierätztechnik). Dabei werden die Membranen bevorzugt in ihrem lipophilen Bereich „gebrochen“, wobei die Membranproteine als Intramembran-Partikel (Durchmesser 5–10 nm) sichtbar werden. Diese in der Membranforschung sehr wichtig gewordene Methode hat entscheidend zum Konzept des modernen „fluid mosaic model“ (Flüssig-Mosaik-Modell [Abb.]) beigetragen. ABC-Transporter, Allosterie, G-Proteine, Membranenzyme, Patching, Peptid-Transporter, Proteine, Transmembran-Facilitatoren. Transmembranhelices.
B.L./S.Kl.
Membranproteine
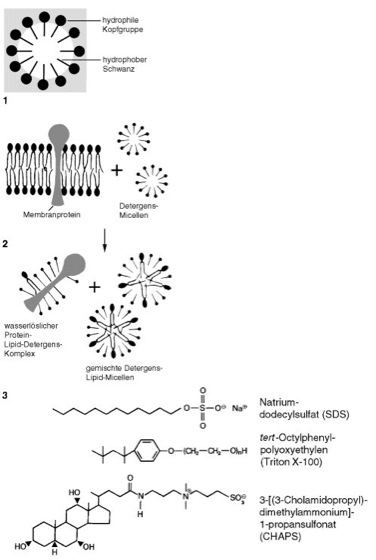
Abb. 1:
Detergentien: Transmembranproteine (integrale Membranproteine) können nur durch solche Agentien aus dem Membranverband herausgelöst werden, welche die hydrophoben Interaktionen aufheben und letztlich die Lipiddoppelschicht zerstören. Diese Aufgabe erfüllen in der Membranbiochemie die Detergentien, kleine amphipathische Moleküle, die in Wasser Micellen (Emulgatoren) bilden können. Ein ideales Detergens sollte das gewünschte Protein von der Membran abtrennen, ohne das Protein zu entfalten; außerdem sollte es leicht wieder zu entfernen sein. Mit Membranen zusammengebracht, können sich die hydrophoben Enden der Detergensmoleküle mit den hydrophoben Bereichen der Membranproteine arrangieren, wobei sie die Lipidmoleküle verdrängen. Die polaren Enden der Detergensmoleküle orientieren sich nach außen zum wäßrigen Milieu. So können derartige Detergens-Protein-Komplexe – meist beinhalten sie auch noch benachbarte Lipidmoleküle aus der Membran – das Membranprotein gleichsam in Lösung bringen. Der polare Molekülteil des Detergens kann entweder geladen sein (anionische oder kationische Detergentien), elektrisch neutral (z.B. Triton X-100) oder als Zwitterion (z.B. CHAPS) vorliegen. Als besonders schonend, d.h. die enzymatische Aktivität der Membranproteine weitgehend erhaltend, haben sich die zwitterionischen und die nicht-ionischen Detergentien erwiesen. Wird das Detergens wieder entfernt, z.B. durch Dialyse, so geht auch dessen solubilisierende Wirkung verloren, und das Protein fällt in wäßriger Lösung als unlösliches Präzipitat aus. Dabei lagern sich die hydrophoben Membranproteinregionen aneinander.
1 Quergeschnittene Detergens-Micelle in Wasser. Die amphipathischen Moleküle ordnen sich so an, daß die hydrophilen Gruppen zur wäßrigen Phase hin orientiert sind. Konzentrationsabhängig kommen Detergentien in wäßrigen Lösungen als Monomere (geringe Detergens-Konzentration) und als Micellen (hohe Konzentration) vor. Eine wichtige Größe ist dabei die kritische micellare Konzentration (CMC), welche die höchste erreichbare Monomerenkonzentration angibt. CMC-Werte liegen im Bereich zwischen 10–2 und 10–6 mol/l. Dabei haben ionische Detergentien höhere CMCs als nicht-ionische. Die Größe einzelner Micellen liegt – je nach Detergens – zwischen 50 und 500 Einzelmolekülen.
2 Solubilisierung von integralen Membranproteinen durch Detergentien.
3 Einige Detergentien
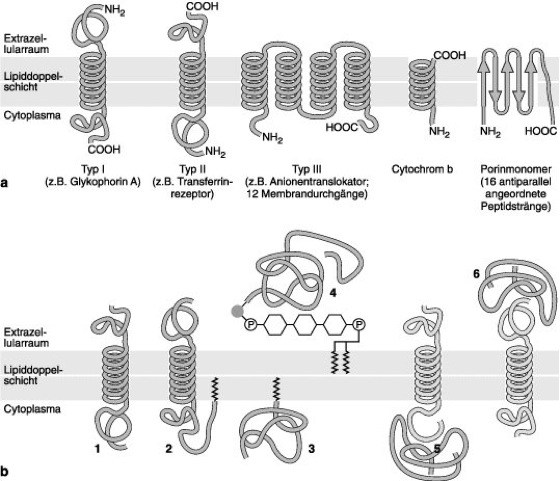
Membranproteine
Abb. 2: a Schemazeichnung der topographischen Anordnung von integralen und peripheren Membranproteinen. Viele Membranproteine durchspannen die Membran mit α-Helix-Bereichen, nur wenige besitzen ein β-Faltblatt als Grundmotiv der Transmembrankomponente (z.B. Porine). b Möglichkeiten der Verknüpfung von Membranproteinen mit der Lipiddoppelschicht. Die meisten Transmembranproteine durchqueren die Membran mit 1 (1) oder mehreren α-Helices und sind zum Teil mit kovalent verbundenen Fettsäureketten mit der cytoplasmatischen Seite der Membran verknüpft (2). Andere Proteine sind nur über eine Fettsäurekette oder eine Prenylgruppe mit der cytoplasmatischen Seite der Membran fest verankert (3) oder seltener mit der dem Cytoplasma abgewandten Seite über Oligosaccharide oder Phosphatidylinositol (4; GPI-Anker). Periphere Proteine sind beiderseits der Membran über nicht kovalente Wechselwirkungen mit integralen Proteinen verbunden (5, 6).
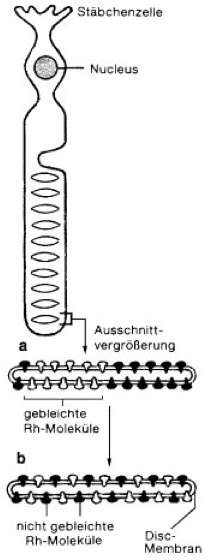
Membranproteine
Abb. 3: Experiment zur Veranschaulichung der lateralen Diffusion von Membranproteinen am Beispiel des Rhodopsins (Rh) in den Membranstapeln der Stäbchenzellen der Retina. a Die linke Seite aller Membranen des Stapels wurde durch intensive Bestrahlung ausgebleicht; b in weniger als 1 Minute haben sich gebleichte und nicht gebleichte Rh-Moleküle durch laterale Diffusion wieder vermischt.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.